题目内容
小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是________.
铜
分析:假设这6.5 g全部为锌,根据方程式计算出生成氢气为0.2g,所以剩余的金属中必须假设都是6.5g时产生氢气的质量必须有比0.2g大的,有比0.2g小的.再进行进一步分析即可.
解答:假设这5.6 g全部为锌,设生成氢气质量为x则:
Zn+HCl═ZnCl2+H2↑
65 2
6.5g x

x=0.2g
依据金属与酸反应时生成的氢气质量= ×金属的质量,可得假设6.5g是铝、镁或铁则生成氢气质量都大于0.2g,所以必须含有产生氢气小于0.2g的金属,在这几种金属中只有铜与酸不反应,所以此锌粉中一定含有的金属杂质是铜.
×金属的质量,可得假设6.5g是铝、镁或铁则生成氢气质量都大于0.2g,所以必须含有产生氢气小于0.2g的金属,在这几种金属中只有铜与酸不反应,所以此锌粉中一定含有的金属杂质是铜.
故答案为:铜;
点评:解答本题的关键是运用假设法,假设5.6g全部是一种金属,看生成氢气的质量的多少,再进行进一步分析.
分析:假设这6.5 g全部为锌,根据方程式计算出生成氢气为0.2g,所以剩余的金属中必须假设都是6.5g时产生氢气的质量必须有比0.2g大的,有比0.2g小的.再进行进一步分析即可.
解答:假设这5.6 g全部为锌,设生成氢气质量为x则:
Zn+HCl═ZnCl2+H2↑
65 2
6.5g x

x=0.2g
依据金属与酸反应时生成的氢气质量=
 ×金属的质量,可得假设6.5g是铝、镁或铁则生成氢气质量都大于0.2g,所以必须含有产生氢气小于0.2g的金属,在这几种金属中只有铜与酸不反应,所以此锌粉中一定含有的金属杂质是铜.
×金属的质量,可得假设6.5g是铝、镁或铁则生成氢气质量都大于0.2g,所以必须含有产生氢气小于0.2g的金属,在这几种金属中只有铜与酸不反应,所以此锌粉中一定含有的金属杂质是铜.故答案为:铜;
点评:解答本题的关键是运用假设法,假设5.6g全部是一种金属,看生成氢气的质量的多少,再进行进一步分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?太原)某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.
(2012?太原)某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.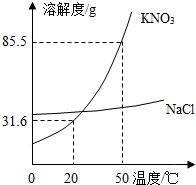 (2013?北辰区一模)实验室欲配制一定溶质质量分数的KNO3溶液,现只有含少量NaCl的KNO3固体样品.
(2013?北辰区一模)实验室欲配制一定溶质质量分数的KNO3溶液,现只有含少量NaCl的KNO3固体样品.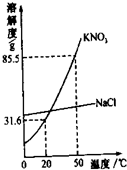 某实验室欲配制一定溶质质量分数的硝酸钾溶液,现实验室只有含少量NaCl的硝酸钾固体药品.
某实验室欲配制一定溶质质量分数的硝酸钾溶液,现实验室只有含少量NaCl的硝酸钾固体药品.
 0℃时,将85.5g固体药品溶于100g水中,得到的是KNO3的________(填“饱和”或“不饱和”)溶液。将KNO3提纯的方法是_____________________
0℃时,将85.5g固体药品溶于100g水中,得到的是KNO3的________(填“饱和”或“不饱和”)溶液。将KNO3提纯的方法是_____________________ 计算、_____、_____、装瓶贴标签。经检测,小明所配溶液中KNO3溶质质量分数偏小,其原因可能是____
计算、_____、_____、装瓶贴标签。经检测,小明所配溶液中KNO3溶质质量分数偏小,其原因可能是____