题目内容
18.已知CaC2(俗称电石)分别在O2中充分燃烧和与水反应可生成W、X、Y、Z四种化合物,其中W、X、Z均为两种元素组成,Y由三种元素组成.CaC2和水反应可看做与水电离出的H+和OH-发生的离子交换反应,它们之间的转化关系如图:
(1)试回答W、X、Y、Z各是什么化合物(写化学式):
WCaO; XCO2;YCa(OH)2;ZC2H2.
(2)写出过量X和Y的水溶液反应的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O、CaCO3+H2O+CO2=Ca(HCO3)2.
分析 电石对大家比较陌生,但是题目给出了化学式.由于和氧气充分燃烧,所以生成的无色气体应该是二氧化碳,同时钙元素和氧元素形成的白色固体物质应该为氧化钙,而氧化钙恰好能和水反应.电石和水的反应,题目给出的信息是相当电离的氢离子和氢氧根离子发生的离子交换,所以应该是碳元素和氢元素结合,而钙元素和氢氧根结合,所以生成物为氢氧化钙(也验证了w可以为氧化钙)和C2H2.C2H2和氧气能反应生成二氧化碳和水.
解答 解:碳化钙,俗名电石,成分为CaC2.由于和氧气充分燃烧,所以生成的无色气体应该是二氧化碳,同时钙元素和氧元素形成的白色固体物质应该为氧化钙,而氧化钙恰好能和水反应.电石和水的反应,题目给出的信息是相当电离的氢离子和氢氧根离子发生的离子交换,所以应该是碳元素和氢元素结合,而钙元素和氢氧根结合,所以生成物为氢氧化钙(是三种元素组成,也验证了w可以为氧化钙)和C2H2.C2H2和氧气能反应生成二氧化碳和水.
(1)写对应物质的化学式为:W CaO; X CO2; Y Ca(OH)2;Z C2H2.
(2)过量二氧化碳通入到澄清石灰水,先浑浊后澄清,是因为最终生成了可溶性的碳酸氢钙.其方程式为:2CO2+Ca(OH)2=Ca(HCO3)2.(审题时注意“过量”一词的存在)
故答案为:
(1)CaO;CO2 ;Ca(OH)2;C2H2.
(2)CO2+Ca(OH)2=CaCO3↓+H2O;CaCO3+H2O+CO2=Ca(HCO3)2.
点评 对于出现陌生物质的推断题,一般考查内容应该是较为熟悉的,所以不要畏惧,慢慢梳理,之后带入对照即可.

练习册系列答案
相关题目
8.超临界流体是物质介于气态和液态之间的新状态,目前应用最广泛的是超临界二氧化碳,超临界CO2流体是一种具有和水相似、能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”.下有关“超临界二氧化碳”列说法正确的是( )
| A. | 它不能与石灰水反应 | |
| B. | 超临界二氧化碳是合成的一种新物质 | |
| C. | 超临界CO2流体性质特殊,但它与干冰的化学组成相同 | |
| D. | 超临界CO2流体是一种特殊的物质,容易燃烧 |
13.下列实验现象描述正确的是( )
| A. | 铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | |
| B. | 高温条件下木炭还原氧化铜:黑色固体逐渐变成光亮的铜 | |
| C. | 电解水实验:两个电极附近产生气泡,一段时间后,正、负极产生的气体体积比约为2:1 | |
| D. | 铜片放人硝酸银溶液中:紫红色固体表面有银白色固体产生,溶液由蓝色逐渐变为无色 |
3.某实验废液中可能含有以下几种离子:Na+、Ca2+、Cl-、Ba2+、SO42-、CO32-,现取两份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加入足量的BaCl2溶液,有白色沉淀产生,再加入过量的稀硝酸沉淀部分溶解.根据上述实验,以下推测中不正确的是( )
| A. | 可能存在Cl- | B. | 一定存在CO32-,一定不存在Ba2+ | ||
| C. | 一定存在Na+ | D. | 一定存在SO42-,可能存在Ca2+ |
10.理科实验操作考试中,小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣.
【提出问题】硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
【设计并实验】室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率.
(1)如表表格中V=15;
(2)写出铝和稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑:
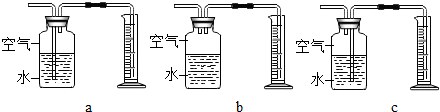
(3)定量收集氢气体积可用如图c(填写字母序号)装置.
【实验现象】随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加.
【结论与解释】
(4)随着硫酸铜体积的增加,反应速率明显变慢可能的原因是部分铝和硫酸铜溶液发生了置换反应;
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是硫酸铜质量发生了改变且和铝发生了反应;
【实验反思】加速铝和稀硫酸反应速率还可以采取的措施是(写出一点)提高温度,增大盐酸浓度等.
【实验拓展】根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
(6)如表中,用水进行实验的目的进行对照;;
(7)上述实验设计存有缺陷,该缺陷是铝片未经过表面打磨;实验改进后,任符合上表中的实验现象,可得到的实验结论是:
①Na+、Mg2+ 对实验效果没有明显效果;②Fe2+、Cu2+能加快铝和稀盐酸反应的速率,且Cu2+ 效果最好.

【提出问题】硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
【设计并实验】室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率.
| 实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
| 饱和硫酸铜溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
| 水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(2)写出铝和稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑:
(3)定量收集氢气体积可用如图c(填写字母序号)装置.
【实验现象】随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加.
【结论与解释】
(4)随着硫酸铜体积的增加,反应速率明显变慢可能的原因是部分铝和硫酸铜溶液发生了置换反应;
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是硫酸铜质量发生了改变且和铝发生了反应;
【实验反思】加速铝和稀硫酸反应速率还可以采取的措施是(写出一点)提高温度,增大盐酸浓度等.
【实验拓展】根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
| 实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
| 加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg(NO3)2溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
| 产生气泡速率 | + | + | + | ++ | +++ |
(7)上述实验设计存有缺陷,该缺陷是铝片未经过表面打磨;实验改进后,任符合上表中的实验现象,可得到的实验结论是:
①Na+、Mg2+ 对实验效果没有明显效果;②Fe2+、Cu2+能加快铝和稀盐酸反应的速率,且Cu2+ 效果最好.
7.下列图象与所述实验相符的是( )
| A. |  向一定量锌粒中加入过量稀硫酸 向一定量锌粒中加入过量稀硫酸 | |
| B. |  向一定量氯化钠饱和溶液中不断加入水 向一定量氯化钠饱和溶液中不断加入水 | |
| C. |  向pH=2的溶液中加入碱性溶液 向pH=2的溶液中加入碱性溶液 | |
| D. |  向一定量氢氧化钠和碳酸钠的混合溶液中加入稀盐酸 向一定量氢氧化钠和碳酸钠的混合溶液中加入稀盐酸 |
