题目内容
有部分变质为Na2CO3的NaOH固体9.3g,与一定量的质量分数为14.6%的稀盐酸恰好完全反应,产生二氧化碳气体2.2g(设气体全部逸出)。求:(1)部分变质的NaOH固体中Na2CO3的质量分数。
(2)用去盐酸的质量是多少克?
解析:
| 解:(1)设固体中含有Na2CO3的质量为x,与Na2CO3反应的盐酸溶液的质量为y。
Na2CO3+2HCl 106 73 44 x y´14.6% 2.2g
∴ 固体中w(Na2CO3)= (2)由(1)知固体中含NaOH的质量=9.3g-5.3g=4g 设与4gNaOH反应需盐酸溶液的质量为z。 NaOH+HCl 40 36.5 4g z´14.6%
∴ 所用盐酸的总质量=25g+25g=50g
|
提示:

氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题。
Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的 (填“开头”、“中间”或“结尾”)。
NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是 (填离子符号)。
Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为 。Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易 ,因此它与生石灰一起用作某些气体的干燥剂
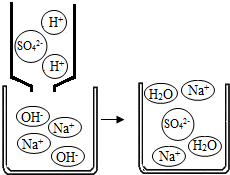
(2)如右图所示,NaOH溶液可与稀酸反应的方程式为 。
该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的 。
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是 (用方程式表示);猜想Ⅲ:全部变质
【实验设计、现象和推断】
|
实验步骤 |
实验现象 |
|
①取少量白色固体于试管中,加水振荡后,至全部溶解 |
无色溶液 |
|
②向试管的溶液中滴加适量物质X的溶液 |
现象A |
|
③再向试管中滴加几滴酚酞试液. |
现象B |
(1)若现象A为有气泡产生,则加入的X溶液是 ,说明猜想 可排除。
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验 (填“能”或“不能”)说明猜想Ⅱ成立。
(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是 。
(4)定量研究:根据上述实验,可通过测定 ,
再通过计算得到氢氧化钠的变质情况。

Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的 (填“开头”、“中间”或“结尾”).
NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是 (填离子符号).
Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为 .
Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易 ,因此它与生石灰一起用作某些气体的干燥剂
(2)如右图所示,NaOH溶液可与稀酸反应的方程式为 .
该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的 .
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究.
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是 (用方程式表示);
猜想Ⅲ:全部变质
【实验设计、现象和推断】
| 实验步骤 | 实验现象 |
| ①取少量白色固体于试管中,加水振荡后,至全部溶解 | 无色溶液 |
| ②向试管的溶液中滴加适量物质X的溶液 | 现象A |
| ③再向试管中滴加几滴酚酞试液. | 现象B |
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验 (填“能”或“不能”)说明猜想Ⅱ成立.
(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是 .
(4)定量研究:根据上述实验,可通过测定 ,再通过计算得到氢氧化钠的变质情况.

 (2013?建邺区一模)氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.
(2013?建邺区一模)氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.