题目内容
“氯碱工业”是我国目前化学工业的重要支柱之一,它的主要原理是电解饱和食盐水,其化学方程式为xNaCl+2H2O xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
请分析并计算回答:
(1)运用质量守恒定律可知上述反应中x= .
(2)通过计算,上述过程中同时产生H2的质量为 g.
(3)计算电解后剩余溶液中NaC1的质量分数(写出详细的计算过程,结果精确到0.1%).
(1)2;(2)0.2g;(3)16%
【解析】
试题分析:(1)根据质量守恒定律,反应前后原子的个数不变,得x=2;
设氢气的质量为x,参加反应的氯化钠的质量为y
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
117 2 71
y x 7.1g
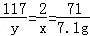
x=0.2g,y=11.7g
(2)产生氢气的质量为0.2g;
(3)电解后剩余溶液中NaC1的质量为:100g×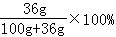 ﹣11.7g=14.8g
﹣11.7g=14.8g
电解后剩余溶液中NaC1的质量分数: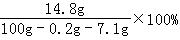 =16%
=16%
答:电解后剩余溶液中NaC1的质量分数为16%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算;质量守恒定律及其应用.

下面是某化学兴趣小组的同学对氢氧化钠部分性质的探究过程:

(1)用手触摸②的烧杯外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会 (填“吸热”或“放热”),该溶液呈 色;③中的溶液显 色.
(2)从③到④溶液的颜色变化不明显,说明④中的溶液呈 性(填“酸”或“碱”).
(3)c溶液和a溶液对比,c溶液颜色更浅.
【提出问题】
为什么继续通入过量的二氧化碳气体溶液颜色会更浅?
【设计实验】
| 实验操作 | 实验现象 | 实验结论 |
甲 | 取少量c溶液滴入稀盐酸 | 有气泡产生 | 溶液中含较多的CO32﹣或HCO3﹣ |
乙 | 另取少量c溶液滴入硝酸钙溶液 | 无明显现象 | 溶液中没有大量的 离子 |
【实验结论】
根据甲、乙两个实验得出的结论,写出甲实验中发生反应的化学方程式: .
【实验反思】
同种反应物在不同的条件下发生化学反应时,可能得到不同的产物.如:碳在氧气中燃烧可以生成 或 .
许多植物花瓣的浸出液遇到酸性或碱性溶液都会呈现出不同的颜色,在化学实验室中,常用作酸碱指示剂.现提取几中植物花瓣的浸出液分别滴入三种溶液中,实验记录如下表:
植物浸出液 | 稀盐酸溶液 | 氯化钠溶液 | 稀氢氧化钠溶液 |
万寿菊 | 黄色 | 黄色 | 黄色 |
牵牛花 | 红色 | 紫色 | 蓝色 |
玫瑰花 | 浅红色 | 浅红色 | 绿色 |
请分析并回答下列问题:
(1)上述花瓣浸出液中,不能作酸碱指示剂的是 .
(2)若将牵牛花浸出液加入到食醋中,溶液会变 色,若将玫瑰花浸出液加入某无色溶液中,溶液变绿色,则该溶液是pH 7(填“>”、“<”或“=”)
在一密闭容器中,有甲、乙、丙、四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量(g) | 24.5 | 5 | 0.1 | 0.4 |
反应后的质量(g) | 0 | 5 | 15 | x |
下列说法正确的是( )
A.乙是反应物 B.丁是催化剂
C.该反应为化合反应 D.X=10