题目内容
将一定质量的锌投入50g稀H2SO4中,恰好完全反应,生成氢气0.2g.求:(1)实验所需锌的质量?
(2)稀硫酸中溶质的质量分数?
分析:(1)利用锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出实验所需锌的质量和所需H2SO4的质量;
(2)根据“溶质的质量分数=
×100%”计算即可.
(2)根据“溶质的质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解;(1)设实验所需锌的质量为x,所需H2SO4的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
∴
=
,
=
,
解之得;x=6.5g,y=9.8g;
(2)稀硫酸中溶质的质量分数为:
×100%=19.6%.
答:(1)实验所需锌的质量为6.5g;(2)稀硫酸中溶质的质量分数为19.6%.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
∴
| 65 |
| 2 |
| x |
| 0.2g |
| 98 |
| 2 |
| y |
| 0.2g |
解之得;x=6.5g,y=9.8g;
(2)稀硫酸中溶质的质量分数为:
| 9.8g |
| 50g |
答:(1)实验所需锌的质量为6.5g;(2)稀硫酸中溶质的质量分数为19.6%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
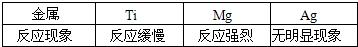
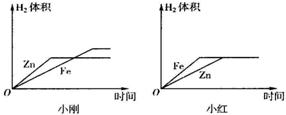
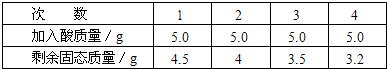
 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________

