题目内容
取含![]() 和
和![]() 的样品4.24g,溶于27.54g水中,待完全溶解后,加入质量分数为10%的盐酸14.6g,盐酸与碳酸钠恰好完全反应。求:(1)样品中碳酸钠的质量分数。(2)反应后所得的溶液中溶质的质量分数。
的样品4.24g,溶于27.54g水中,待完全溶解后,加入质量分数为10%的盐酸14.6g,盐酸与碳酸钠恰好完全反应。求:(1)样品中碳酸钠的质量分数。(2)反应后所得的溶液中溶质的质量分数。
解析:
|
设样品中
106 73 117 44
解得: ①样品中 原 ②所得溶液中 |
提示:
|
题目提供的数据较多,要抓住关键“ |

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案某学校研究性学习小组,以某工厂生产过程中产生的废弃物“红色铁泥”为研究对象,探究红色物质的成分,请你参与他们的活动.
【小组讨论】同学们对“铁泥”中所含红色物质作了如下猜想:
甲同学:红色物质是铜 乙同学:红色物质是氧化铁
丙同学:红色物质是氢氧化铁 丁同学:红色物质是氧化铁和氢氧化铁
【资料在线】①该厂“红色铁泥”主要是生产过程中使用铁触媒(一种催化剂)后的废弃物,除红色物质外,还含有通常不与酸、碱、氧气反应及受热不发生分解的物质; ②氢氧化铁受热时,会分解产生氧化铁和水.
【实验验证】为验证上述四位同学的猜想,小明、小红两位同学进行了如下实验:小明取一定量“红色铁泥”样品,加入稀硫酸,观察到有黄色溶液产生,于是得出“乙同学的猜想成立”的结论;
小红同学按下列顺序进行实验:先取适量已晒干的“红色铁泥”,称量其质量为m1g; 再将“红色铁泥”置于坩埚中充分加热并在干燥器中冷却后,称量其质量为m2g.
【问题讨论】请回答下列问题:
(1)其他同学一致认为,小明同学得出的“乙同学的猜想成立”的结论不合理,理由是______;
(2)针对小红同学的实验操作及测定的两个数据,进行分析:
①若甲同学的猜想成立,则实验中反应的化学方程式为______;
②若m1=m2,则______(填“甲”、“乙”或“丙”)同学的猜想成立;
【拓展应用】
应用之一:若“红色铁泥”中“红色物质是氢氧化铁”,可应用下列实验方案回收“红色铁泥”中的铁元素制得“铁红”(化学式为Fe2O3,是红色油漆的重要原料):

(1)上述过程中发生了三个反应,写出其中的一个化学方程式:______;
(2)a、b是同一实验操作,该操作需要的玻璃仪器有:烧杯、玻璃棒和______;
(3)若通过上述途径获得的“铁红”的纯度(Fe2O3的质量分数)不高,试分析可能的原因____________(说出一点即可).
应用之二:为了测定用以上方法制得的“铁红”的纯度,同学们又进行了下列实验探究.请你参与过程分析与交流.
查阅资料:草酸(乙二酸H2C2O4)在浓H2SO4存在下发生下列反应:H2C2O4 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
实验准备:按右图安装好实验装置:

实验数据:取10g“铁红”样品进行实验,所得实验数据有右表所示甲、乙两组:
| 甲组数据 | 乙组数据 | ||
| 玻璃管连同样品的质量 | E装置连同药品的质量 | ||
| 实验前 | 试验后 | 实验前 | 试验后 |
| 60g | 57.6g | 100g | 107g |
(1)同学们拟用纯净的CO还原“铁红”,所设计的实验装置中B、C盛放的试剂的作用依次是______、______;
(2)从环保角度看,请你提出改进该实验装置的建议______;
(3)从实验安全和实验操作程序看,首先要检查装置的气密性,实验开始先加热______(填“A”或“D”)处,实验结束时,应______(填“先”或“后”)停止D处的加热;
(4)同学们认为,若用乙组数据进行计算“铁红”的纯度,则实验测定结果却偏大,分析造成偏大的原因可能是______;
(5)请依据甲组数据,计算该“铁红”样品的纯度.(写出计算的过程)
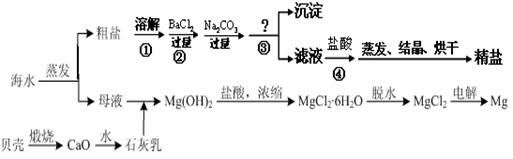
兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 ; .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 ; .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
|
|
| 样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)