题目内容
在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:

(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系的曲线,如图.

(2)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在2 mL~10 mL之间时:________;
②加入盐酸的量在10 mL~20 mL之间时:________.
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答案:
解析:
解析:
|
(1)图略 (2)①随盐酸量增加,中和反应放出热量增大,溶液温度上升 ②过量盐酸起冷却降温作用,反应停止,热量散失 (3)不合理,因为固体氢氧化钠溶于水也要放热. |

练习册系列答案
相关题目
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数 .
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升 mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
试在坐标系中绘出溶液温度变化与加入盐酸体积之间的变化关系图.
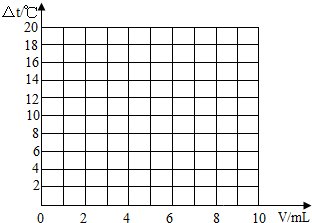
(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识. .
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |

(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.

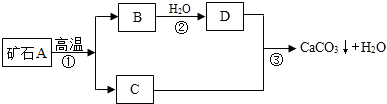
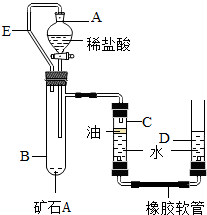 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.


