题目内容
16. 2014年3月22日是第二十二届“世界水日”,水与人类的生活和生产密切相关,请回答下列问题:
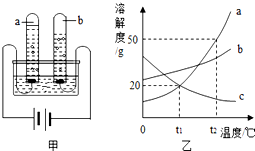
2014年3月22日是第二十二届“世界水日”,水与人类的生活和生产密切相关,请回答下列问题:(1)图甲是水通电分解的示意图,在实验过程中,试管a中产生的气体是氧气(填名称)该实验说明水是由氢元素和氧元素组成.
(2)水是最常见的溶剂,将少量下列物质分别加入水中,不能形成溶液的是A、D
A.面粉 B.白糖 C.纯碱 D.植物油 E.硝酸钾
(3)图乙为a、b、c三种物质的溶解度曲线
①t2℃时将30ga物质加入到50g水中,充分溶解,所得溶液的质量为75g
②将t2℃时a、b、c三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数大小关系为b>a>c
(4)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾受热时发生的反应为4K2FeO4 $\frac{\underline{\;\;△\;\;}}{\;}$2R+4K2O+3O2↑,则R是Fe2O3(填化学式)
分析 (1)根据电解水的试验现象和结论分析;
(2)根据溶液的特征分析;
(3)根据溶解度曲线所能体现的意义来分析解答;
(4)根据质量守恒定律反应前后原子的种类及数目不变分析R的化学式.
解答 解:(1)试管a与正极相连,产生的是氧气,电解水时生成的是氢气和氧气,证明水是由氢元素和氧元素组成的.
故填:氧气;氢元素和氧元素;
(2)面粉、植物油溶于水不能形成均一稳定的混合物,不能形成溶液;白糖、纯碱、硝酸钾溶于水会形成均一稳定的混合物,能形成溶液;
故填:A、D.
(3))①t2°C 时a物质的溶解度为50g,也就是在该温度下,100g水中最多溶解50ga物质达到饱和状态,故在该温度下,50g水中最多溶解25ga物质,所得溶液的质量为75g;
故填:75g;
②由于在t2℃时,三种物质的溶解度大小关系是a>b>c,即在t2℃时,三种物质的饱和溶液中溶质的质量分数:a>b>c;由于a和b的溶解度随温度的降低而减小,因此降温至t1℃时,a和b的溶液中都会有晶体析出,溶液都还是饱和溶液,由于在t1℃时三种物质的溶解度b>a=c,而由于c的溶解度随温度的降低而增大,因此降温至t1℃时,它的饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变,所得溶液溶质质量分数大小的比较,其关系是b>a>c.
故填:b>a>c.
根据反应的化学方程式4K2FeO4$\frac{\underline{\;\;△\;\;}}{\;}$2R+4K2O+3O2↑,反应物中钾、铁、氧原子个数分别为8、4、16,反应后的生成物中钾、铁、氧原子个数分别为8、0、10,根据反应前后原子种类、数目不变,则2R中含有4个铁原子和6个氧原子,则每个R分子由2个铁原子和3个氧原子构成,则物质R的化学式为Fe2O3.
故答案是:Fe2O3.
点评 本题难度不大,主要考查了水电解试验、固体溶解度曲线所表示的意义等,培养学生应用知识解决问题的能力.

 字词句段篇系列答案
字词句段篇系列答案(1)将面粉、食盐、汽油、碘4种物质分别加入水中,能形成溶液的是食盐.
(2)某同学在一定条件下,向质量均为100g的四份水中分别加入一定质量的硝酸钾,搅拌至充分溶解(如有不溶解的硝酸钾,则过滤去),得到溶液,该学生在实验中记录数据如表所示
| 实验序号 | 实验1 | 实验2 | 实验3 | 实验4 |
| 水的质量(g) | 100 | 100 | 100 | 100 |
| 加入硝酸钾的质量(g) | 80 | 100 | 120 | 140 |
| 溶液的质量(g) | 180 | 200 | 210 | 210 |
(3)为了配制50g质量分数为6%的氯化钠溶液,需进行如下操作:
①计算:配制50g质量分数为6%的氯化钠溶液需氯化钠3g和水47g
②称量:用托盘天平称量所需氯化钠时,发现托盘天平的指针偏向左盘,应D.(填字母)
A.调节平衡螺母 B.减少适量的砝码C.增加适量的氯化钠固体 D.减少氯化钠固体
③量取:用50mL(填“10mL”或“20mL”或“50mL”)
④溶解:将两者置于烧杯中,用玻璃棒搅拌,使氯化钠溶解
⑤若要使该溶液的溶质质量分数增加一倍,下列做法中正确的是C(填字母)
A.加入10g氯化钠晶体 B.加入20g氯化钠晶体C.蒸发掉25g水 D.蒸发掉50g水
(4)若32.5g锌与245g稀硫酸恰好完全反应,计算该稀硫酸的溶质质量分数(写出计算过程)
| A. | 大蒜素由C6H10和S组成 | |
| B. | 大蒜素属于氧化物 | |
| C. | 一个大蒜素分子由6个碳原子、10个氢原子和3个硫原子构成 | |
| D. | 大蒜素中碳、氢、硫三种元素的质量比为6:10:3 |
| A | 性质与用途 | B | 安全常识 |
| N2性质稳定--用作保护气 Al2(OH)3--用于治疗胃酸过多症 | 室内装修污染--由甲醛引起 煤气中毒--由一氧化碳引起 | ||
| C | 元素与人体健康 | D | 物质的除杂 |
| 缺钙--易患贫血 缺铁--易患骨质疏松或佝偻病 | 除去NaCl中的Na2CO3--加盐酸 除去铜粉中铁粉--用磁铁吸引 |
| A. | A | B. | B | C. | C | D. | D |
(1)下列说法中不正确的是BD.(填字母代号)
A.酸和碱都含有氢元素 B.生成盐和水的反应一定是中和反应
C.多数酸和碱有腐蚀性 D.酸和碱能与所有的盐发生复分解反应
(2)为探究酸、碱的化学性质,某小组做了如图所示实验.

I、实验后某试管中为红色溶液,向其中加入一定量的某溶液后,红色消失变为无色,该反应的化学方程式为2HCl+Ca(OH)2═CaCl2+2H2O.
II、实验结束后,将得到的蓝色溶液和无色溶液倒入同一个干净的烧杯中,可观察到有蓝色沉淀生成,解释其原因?2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
(3)某敞口放置的氢氧化钠溶液已变质,用方程式表示其变质的原因2NaOH+CO2═Na2CO3+H2O.
为证明该瓶氢氧化钠溶液未完全变质,设计了以下实验,请将表格填写完整.
| 实验操作 | 现象 | 结论 |
| 取少量该样品,滴入足量的 CaCl2溶液,充分反应后过滤. | 有白色沉淀生成 | 有关反应的化学方程式: CaCl2+Na2CO3═CaCO3↓+2NaCl |
| 在滤液中,滴入几滴 无色酚酞试液 | 溶液变红 | 样品未完全变质,仍含有氢氧化钠. |
| 元素信息 | 元素名称 | |
| A | 这种元素在地壳中含量第一 | 铝 |
| B | 存在于人体骨骼中,缺乏该元素会发生骨质疏松 | 钠 |
| C | 这种元素在空气中含量第一 | 氧 |
| D | 常见的金属元素,人体缺乏该元素会导致贫血 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 都能观察到黑色物质变成红色 | B. | 氧化铜都是氧化剂 | ||
| C. | 澄清石灰水都变浑浊 | D. | 都是置换反应 |
 肖红同学在研究分子的性质时,做如如图所示实验.在一个小烧杯里放半杯水,然后用药匙取一小粒品红,放入烧杯.
肖红同学在研究分子的性质时,做如如图所示实验.在一个小烧杯里放半杯水,然后用药匙取一小粒品红,放入烧杯.