题目内容
10.如图为含铜废料中回收铜的一种方案,回答下列问题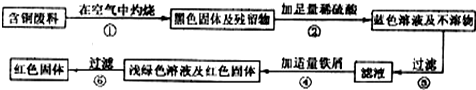
(1)实验中两次进行过滤,实验室进行过滤时,不要用到下列仪器中的D
A.铁架台 B.玻璃棒 C.烧杯 D.试管夹
(2)上述实验中,步骤①、④发生反应的化学方程式分别为:
步骤①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
步骤④Fe+CuSO4═Cu+FeSO4.
(3)步骤⑤得到的固体中,若仍有少量铁,怎么除去?请写出一种方法:加入稀盐酸.
分析 (1)根据过滤需要的仪器进行分析;
(2)根据反应①铜和氧气在加热的条件下生成氧化铜,反应④是铁和硫酸铜反应生成硫酸亚铁和铜进行分析;
(3)根据铁会与盐酸反应,而铜不会与盐酸反应进行分析.
解答 解:(1)过滤需要的仪器有烧杯、漏斗、玻璃棒,不需要试管夹,故选:D;
(2)反应①铜和氧气在加热的条件下生成氧化铜,化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
反应④是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═Cu+FeSO4;
(3)铁会与盐酸反应,而铜不会与盐酸反应,所以除去少量铁的方法是:加入稀盐酸.
故答案为:(1)D;
(2)2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
Fe+CuSO4═Cu+FeSO4;
(3)加入稀盐酸.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.“只需一滴,清水就能变高汤”.“一滴香”是一种食品添加剂,营养价值不高,长期过量食用将危害人体健康.其成分之一为乙基麦芽酚(化学式为C7H8O3),下列关于乙基麦芽酚说法中正确的是( )
| A. | 含1个臭氧分子 | B. | 乙基麦芽酚的相对分子质量为140 | ||
| C. | 该物质为氧化物 | D. | C、H、O的元素质量比为7:8:3 |
5.下列推理正确的是( )
| A. | 原子是呈电中性的微粒,所以呈电中性的微粒一定是原子 | |
| B. | 置换反应都有单质生成,所以有单质生成的反应一定是置换反应 | |
| C. | 燃烧需要同时满足三个条件才能发生,所以灭火也一定要同时控制这三个条件 | |
| D. | 化合物是不同元素组成的纯净物,所以由不同元素组成的纯净物一定是化合物 |
15.同学们已经学习了有关金属的一些知识,对金属的活动性顺序也有了一定的认识.请运用所学知识参与以下探究并回答相关问题.
[实验一]将4枚洁净无锈的铁钉分别放入如图1a、b、c、d 4支试管中
上述实验中,b试管中的铁钉最易生锈.
[实验二]为了探究Fe、Cu、Al三种金属的活动性顺序,小宁同学做了如图2所示的实验.
(1)实验时观察到铝和铁表面均覆盖一层红色的物质,得出的结论是铝和铁的金属活动性比铜强;写出其中一种金属与硫酸铜溶液反应的化学方程式Fe+CuSO4═Cu+FeSO4..
(2)小伟同学认为小宁同学设计的实验不能达到实验目的,原因是无法比较铝和铁的金属活动性,因此另设计一个实验,才能得出正确的结论.请你设计一个实验并完成下表:
[实验一]将4枚洁净无锈的铁钉分别放入如图1a、b、c、d 4支试管中

上述实验中,b试管中的铁钉最易生锈.
[实验二]为了探究Fe、Cu、Al三种金属的活动性顺序,小宁同学做了如图2所示的实验.
(1)实验时观察到铝和铁表面均覆盖一层红色的物质,得出的结论是铝和铁的金属活动性比铜强;写出其中一种金属与硫酸铜溶液反应的化学方程式Fe+CuSO4═Cu+FeSO4..
(2)小伟同学认为小宁同学设计的实验不能达到实验目的,原因是无法比较铝和铁的金属活动性,因此另设计一个实验,才能得出正确的结论.请你设计一个实验并完成下表:
| 操作 | 现象 | 结论 |
| 将相同状态的铁、铜、铝分别放入相同条件下的稀盐酸中 | 铝、铁表面有气泡产生,且与稀盐酸反应时铝比铁剧烈.铜无明显现象. | 三种金属活动性由强到弱的顺序是:Al、Fe、Cu |
2.下列物质不属于空气污染物的是( )
| A. | SO2 | B. | NO2 | C. | CO2 | D. | CO |
3.如图是钠与氯气(Cl2)反应生成氯化钠的模拟图.下列说法不正确的是( )


| A. | 钠原子转移一个电子给一个氯原子 | B. | 反应中氯气分解为氯原子 | ||
| C. | 核外电子在反应中有重要作用 | D. | 氯化钠由氯化钠分子构成 |

 物质A-F及它们之间的转化都是我们已经学过的,其中E的用途之一是炼钢,C能够使紫色石蕊变红,B和F都是由两种元素组成的氧化物且组成元素相同,A是实验室制备B的原料之一,它们之间的相互转化关系如图所示,部分反应物、生成物和反应条件未标出,请回答下列问题:
物质A-F及它们之间的转化都是我们已经学过的,其中E的用途之一是炼钢,C能够使紫色石蕊变红,B和F都是由两种元素组成的氧化物且组成元素相同,A是实验室制备B的原料之一,它们之间的相互转化关系如图所示,部分反应物、生成物和反应条件未标出,请回答下列问题: