题目内容
40℃时,硫酸钠的溶解度为50克,现有该温度下硫酸钠的饱和溶液213克,与200克氯化钡溶液完全反应,将生成的沉淀滤出、干燥,称得质量为分析:根据题意先计算饱和溶液中所含溶质硫酸钠的质量,在根据化学方程式进行相应的计算.
解答:解:设:213g硫酸钠饱和溶液中溶质的质量为x
=
x=71g
设:硫酸钠和氯化钡反应生成沉淀的质量为y,生成的氯化钠的质量为z
Na2SO4 +BaCl2 =BaSO4 +2NaCl
142 233 117
71g y z
=
y=116.5g
=
z=58.5g
故生成的沉淀的质量为116.5g,滤液中溶质氯化钠的质量分数为
×100%≈19.7%
故答案为:116.5、19.7%.
| 50g |
| 50g+100g |
| x |
| 213g |
x=71g
设:硫酸钠和氯化钡反应生成沉淀的质量为y,生成的氯化钠的质量为z
Na2SO4 +BaCl2 =BaSO4 +2NaCl
142 233 117
71g y z
| 142 |
| 71g |
| 233 |
| y |
| 142 |
| 71g |
| 117 |
| z |
故生成的沉淀的质量为116.5g,滤液中溶质氯化钠的质量分数为
| 58.5g |
| 213g+200g-116.5g |
故答案为:116.5、19.7%.
点评:本题主要考查饱和溶液中溶质质量、溶液中溶质质量分数的计算方法以及根据化学方程式进行计算的能力.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
前进中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取40g混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:
试回答:
(1)据表可推知:表中第 份中,BaCl2与Na2SO4恰好完全反应.
(2)原混合物中硫酸钠的质量分数是多少.(精确到小数点后一位)
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 加入氯化钡溶液质量(g) | 10 | 20 | 30 | 40 |
| 反应得到沉淀的质量(g) | 2.33 | 4.66 | 6.99 | 6.99 |
(1)据表可推知:表中第
(2)原混合物中硫酸钠的质量分数是多少.(精确到小数点后一位)
东方中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取20g混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:
若有关的化学反应为:Na2SO4+BaCl2=BaSO4↓+2NaCl,请计算:
(1)未知氯化钡溶液的质量分数为多少.
(2)原混合物中硫酸钠的质量分数是多少.(精确到0.01)
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 加入氯化钡溶液质量(g) | 15 | 20 | 25 | 30 |
| 反应得到沉淀的质量(g) | 1.40 | 1.86 | 2.33 | 2.33 |
(1)未知氯化钡溶液的质量分数为多少.
(2)原混合物中硫酸钠的质量分数是多少.(精确到0.01)


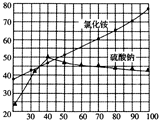 12、如图是氯化铵和硫酸钠在水中的溶解度曲线,请据图回答下列问题:
12、如图是氯化铵和硫酸钠在水中的溶解度曲线,请据图回答下列问题: