题目内容
【题目】下列是实验室常用仪器,回答下列问题:
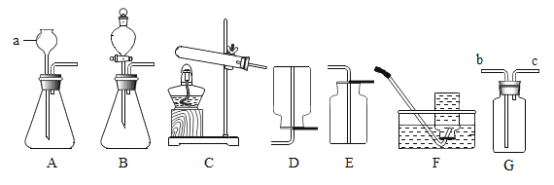
(1)写出带标号的仪器的名称:a_____。
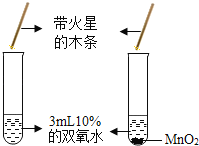
(2)若实验室用高锰酸钾制取氧气,其化学方程式为_____;若从控制反应速率和节约药品考虑,选择的发生装置为_____,收集装置为_____;若用装满水的G装置来收集氧气,则气体应从_____(填b或c)端通入;
(3)某气体只能用E装置来收集,由此可推测该气体具有的哪些性质_____。
【答案】长颈漏斗 ![]() B E或F或G c 密度比空气大,溶于水或与水反应
B E或F或G c 密度比空气大,溶于水或与水反应
【解析】
(1)分液漏斗可以控制反应的速率,故答案为:分液漏斗;
(2)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学反应方程式为:![]() ;分液漏斗可以控制反应速率和节约药品,用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,可选用装置B;氧气密度比空气大,比水小,收集装置为E或F或G;若用装满水的G装置来收集氧气,则气体应从短管进入。
;分液漏斗可以控制反应速率和节约药品,用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,可选用装置B;氧气密度比空气大,比水小,收集装置为E或F或G;若用装满水的G装置来收集氧气,则气体应从短管进入。
(3)若某气体只能用E装置来收集,密度比空气大,易溶于水或与水反应。

 名校课堂系列答案
名校课堂系列答案【题目】根据下表回答问题.
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度(g/100g水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
①20℃时,溶解度最大的物质是_____.
②50℃时,100g水中最多溶解NaCl_____g.
③A是80℃含有120g水的KNO3溶液.经过如下操作,得到102gKNO3固体.
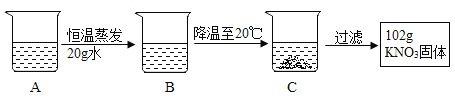
(1)A溶液为_____(选填“饱和”或“不饱和”)溶液.
(2)对以上过程的分析,正确的是_____(选填编号).
A A到B的过程中,溶质质量没有改变
B B中溶质与溶剂的质量比为169:100
C 开始析出KNO3固体的温度在60℃至80℃之间
D A溶液的质量等于222g