题目内容
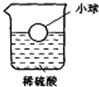 如图,在稀硫酸中漂浮一塑料小球(不与盐酸以及其他物质反应),向烧杯中加入少量Zn粉,充分反应后,塑料小球会略微
如图,在稀硫酸中漂浮一塑料小球(不与盐酸以及其他物质反应),向烧杯中加入少量Zn粉,充分反应后,塑料小球会略微考点:盐的化学性质
专题:学科交叉型
分析:据锌片与硫酸反应以及与硫酸铜反应后溶液的溶质的相对分子质量的改变,推出溶液密度的变化,即溶质相对分子质量越大,溶液密度越大,溶质相对分子质量越小,溶液密度越小;根据浮力公式,溶液密度越大,小球所受浮力越大,小球会向上运动,溶液密度越小,小球所受浮力越小,小球会向下运动.
解答:解:锌的金属活动性在H前,因此可与酸反应生成H2;当锌与稀硫酸反应后,溶液中的溶质发生了改变,由硫酸变成了硫酸锌,其相对分子质量增大了,根据ρ=
,在体积没有明显改变的情况下,溶液密度ρ也相应增大;而根据浮力F=ρvg,溶液对小球的浮力变大,因此小球会向上运动.若将烧杯中的稀盐酸换成不与塑料反应的CuSO4溶液,锌与硫酸铜反应后,溶液中的溶质发生了改变,由硫酸铜变成了硫酸锌,其相对分子质量增大了,同理小球会向上运动
故答案为:上浮;上浮.
| m |
| v |
故答案为:上浮;上浮.
点评:同学们要学会判断化学反应后溶液中溶质的判断,并根据其相对分子质量的变化判断出溶液密度的变化.

练习册系列答案
相关题目
下列变化中,属于化学变化的是( )
| A、水分子间隙变大 |
| B、分离液态空气 |
| C、一种分子变成另一种分子 |
| D、汽车轮胎爆炸 |
下列实验对应的图象正确的是( )
| A | B | C | D |
| 将等质量的镁和锌分别与足量的盐酸反应 | 向pH=2的盐酸中滴加过量的氢氧化钠溶液 | 向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液 | 向pH=12的氢氧化钠溶液中加水稀释 |
 |  |  |  |
| A、A | B、B | C、C | D、D |
下列关于催化剂的叙述中,正确的是( )
| A、催化剂能改变其他物质的化学反应速率 |
| B、催化剂本身的质量和性质在化学反应前后改变 |
| C、不使用二氧化锰作催化剂,加热过氧化氢溶液不会放出氧气 |
| D、使用二氧化锰作催化剂,可以增加过氧化氢溶液分解放出氧气的质量 |
 A、B、C、D、E、五种物质均为初中化学种常见的化合物,它们之间的关系如图所示,相互之间连线表示能发生化学反应.A、C、E、均为氧化物,A是人体呼出的主要气体;在实验室中B是用来制取A,而D可以用来检验A;C和E反应能生成D.
A、B、C、D、E、五种物质均为初中化学种常见的化合物,它们之间的关系如图所示,相互之间连线表示能发生化学反应.A、C、E、均为氧化物,A是人体呼出的主要气体;在实验室中B是用来制取A,而D可以用来检验A;C和E反应能生成D.
 溶液是否饱和与溶液的“浓”“稀”之间没有必然的联系,不能根据溶液的“浓”“稀”来判断溶液是否饱和,只有当溶液、溶质、温度相同时,饱和溶液才一定比不饱和溶液浓.例如20℃时的NaCl饱和溶液比20℃时的NaCl不饱和溶液浓,具体关系可如图所示,则图中有A、B两种情况,请举例说明.
溶液是否饱和与溶液的“浓”“稀”之间没有必然的联系,不能根据溶液的“浓”“稀”来判断溶液是否饱和,只有当溶液、溶质、温度相同时,饱和溶液才一定比不饱和溶液浓.例如20℃时的NaCl饱和溶液比20℃时的NaCl不饱和溶液浓,具体关系可如图所示,则图中有A、B两种情况,请举例说明.