题目内容
某课外小组的同学为了探究金属活动顺序,设计下列实验进行研究,请你一起来完成实验报告:
(1)取A、B、C三支试管,分别放入2%的硫酸溶液,然后在A试管中加入用砂纸擦过的铜丝;在B试管中加入用砂纸擦过的铁丝;在C试管中加入用砂纸擦过的镁条,观察到A试管无明显现象;B试管反应较缓慢,有少量气泡产生;C试管出现________现象,通过上述实验,你可以得出的结论是________.此实验中所用稀硫酸的溶质质量分数相同,其原因是________.
(2)为了进一步验证上述结论,某同学取一支试管,把砂纸擦过的铁丝投入15%硫酸铜溶液中,观察到的现象是________,通过实验得出的结论是________.
(3)为了继续探究请再设计实验方案,比较铜与锌的金属活动顺序:
实验步骤:________;
实验现象:________;
实验结论:________.
答案:
解析:
解析:
|
(1)剧烈反应,产生大量气泡,金属活动顺序:Mg>Fe>Cu,控制Mg、Fe与硫酸溶液反应条件相同,才能得到镁与铁金属活动性强弱; (2)蓝色溶液变浅绿色,铁丝表面变红色,金属活动顺序:Fe>Cu; (3)取一支试管,把砂纸擦过的锌片投入15%的硫酸铜溶液中,蓝色溶液变无色,锌片表面变红色,金属活动顺序:Zn>Cu(其他合理的答案均给分) (或取A、B两支试管,分别放入2%的硫酸溶液,在A试管中加入用砂纸擦过的锌片,在B试管中加入用砂纸擦过的铜片;A试管中产生大量气泡,B试管中无明显现象;金属活动顺序:Zn>Cu) |

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
某课外小组的同学为了探究金属活动顺序,设计如图所示的实验进行研究.
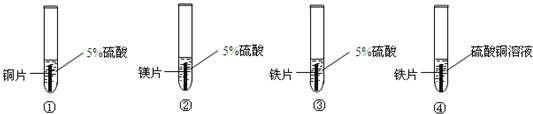
(1)将实验现象填入表中
| 装置编号 | 实验现象 |
| ① | 金属表面无明显现象 |
| ② | |
| ③ |
(2)为了进一步验证上述结论,甲同学设计以下实验:把铁片投入15%硫酸铜溶液中(如图④),观察到的现象是______.我国古代“湿法冶铜”就是利用这个反应原理,请写出该反应的化学方程式______,若5.6g铁投入到足量的15%硫酸铜溶液中,能生成铜的质量为______.
某课外小组的同学为了探究金属活动顺序,设计如图所示的实验进行研究.

(1)将实验现象填入表中
通过上述实验,你可以得出的结论是______.此实验中所用稀硫酸的溶质质量分数必须相同,其原因是______.
(2)为了进一步验证上述结论,甲同学设计以下实验:把铁片投入15%硫酸铜溶液中(如图④),观察到的现象是______.我国古代“湿法冶铜”就是利用这个反应原理,请写出该反应的化学方程式______,若5.6g铁投入到足量的15%硫酸铜溶液中,能生成铜的质量为______.

(1)将实验现象填入表中
| 装置编号 | 实验现象 |
| ① | 金属表面无明显现象 |
| ② | |
| ③ |
(2)为了进一步验证上述结论,甲同学设计以下实验:把铁片投入15%硫酸铜溶液中(如图④),观察到的现象是______.我国古代“湿法冶铜”就是利用这个反应原理,请写出该反应的化学方程式______,若5.6g铁投入到足量的15%硫酸铜溶液中,能生成铜的质量为______.

 某课外小组的同学们收集了含一氧化碳和二氧化碳的废气,为了确认这种废气的组成,他们在实验室按如下装置进行了实验.
某课外小组的同学们收集了含一氧化碳和二氧化碳的废气,为了确认这种废气的组成,他们在实验室按如下装置进行了实验.