题目内容
【题目】同学们需要7.5 g食盐和42.5 mL水用于实验,如图为实验操作过程:

(1)称取7.5 g食盐时,1 g以下需要移动游码,若按如图操作,天平平衡时,实际称得的药品质量是_____g。
(2)按正确操作称取食盐时,发现指针偏向右侧,应如何操作(____)。
A 减少砝码 B 增加食盐 C 调节平衡螺母
(3)需要量取42.5 mL水,量筒的规格应选择_____ (填“20”“50”或“100”)mL。图示最后一步操作中,玻璃棒的作用是_______________。
(4)经检测,配制出来的NaCl溶液溶质质量分数偏小,其原因可能有_____(填序号)。
①氯化钠固体不纯
②称好的食盐有部分洒落到烧杯外
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
【答案】6.5 B 50 搅拌加速溶解 ①②③
【解析】
(1)称取7.5 g食盐时,1 g以下需要移动游码,若按如图操作,“左码右物”;天平平衡时,实际称得的药品质量是=7g-0.5g=6.5g
(2)按正确操作称取食盐时,发现指针偏向右侧,说明左侧药品质量偏小,应如何操作:增加食盐;
故选:B。
(3)需要量取42.5 mL水,量筒的规格应选择50mL(量筒的量程稍大于水的体积,测量更准确)。图示最后一步搅拌操作中,玻璃棒的作用是:加速溶解;
(4)经检测,配制出来的NaCl溶液溶质质量分数偏小,其原因可能有:
①氯化钠固体不纯,导致溶质质量偏小,溶质质量分数偏小;
②称好的食盐有部分洒落到烧杯外,导致溶质质量偏小,溶质质量分数偏小;
③量取水时,仰视读数,导致量取水的体积偏大,溶质质量分数偏小;
④装瓶时,溶液已经配置完成,有少量溶液洒出,溶质质量分数不变;
故选:①②③。

【题目】玲玲在学习复分解反应时,对复分解反应发生的条件产生了兴趣,于是她和小组内的同学仅用以下药品展开了探究活动。
实验药品:稀硫酸、稀盐酸、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、NaCl溶液、酚酞溶液
(提出问题)他们要探究的问题是_____。
(查阅资料)Ba(NO3)2溶液显中性,且Ba2+有毒。
(实验探究)玲玲用上述物质做了下列几组实验
组合序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
组合物质 | H2SO4 NaOH | H2SO4 NaCl | H2SO4 Na2CO3 | H2SO4 Ba(NO3)2 | NaOH Ba(NO3)2 | Na2CO3 Ba(NO3)2 |
(记录和解释)
(1)组合①、②、⑤均无明显现象,其中组合_____与另外两组的实质不同.为证明该不同之处,玲玲在实验过程中使用了酚酞溶液。
(2)请写出组合③的化学方程式_____。
(实验结论)他们请教老师并讨论后知道,只有当两种化合物互相交换成分,生成物中有沉淀或_____生产时,复分解反应才可以发生。
(拓展延伸)实验结束后,他们将所有废液收集在废液缸中静置,观察到白色沉淀和无色的上层清液.为了确定沉淀和清液的成分,继续展开探究。
(实验1)探究沉淀的成分。
(提出猜想)Ⅰ.沉淀只有BaSO4
Ⅱ.沉淀只有BaCO3
Ⅲ.沉淀中含有BaSO4和BaCO3
梅梅取少量沉淀于试管中,滴加_____(请补充完整实验操作和观察到的现象),证明了猜想Ⅲ是正确的。
(实验2)探究清液的成分
①取少量清液于试管中,向其中滴加几滴Ba(NO3)2溶液,无明显现象。
②另取少量清液于另一支试管中,滴入几滴_____,有白色沉淀产生。
(解释与结论)探究活动结束后,小组内成员通过讨论分析,一致认为清液中含有的离子是_____(指示剂除外)。
(处理废液)为了防止污染环境,玲玲向废液缸中加入适量的_____,对废液进行处理后,将固体回收进一步处理,溶液排放。
(交流与反思)根据你对物质溶解性的了解,结合复分解反应发生的条件,请写出一种在水溶液中一般不能发生复分解反应的可溶性盐_____(写化学式)。
【题目】为了测定某黄铜![]() 铜锌合金
铜锌合金![]() 样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入硫酸,充分反应后用天平称量,记录实验数据如下:
样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入硫酸,充分反应后用天平称量,记录实验数据如下:
试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
所取样品的质量
|
|
|
|
|
加入稀硫酸的质量 |
|
|
|
|
生成气体的质量 |
|
|
|
|
请回答下列问题并计算:
![]() 经分析,在第1次实验结束后,反应物______完全反应完了。
经分析,在第1次实验结束后,反应物______完全反应完了。
![]() 样品与足量稀硫酸反应最多能生成气体______g
样品与足量稀硫酸反应最多能生成气体______g
![]() 计算样品中锌的质量分数
计算样品中锌的质量分数![]() 写出具体计算过程
写出具体计算过程![]() 。______
。______
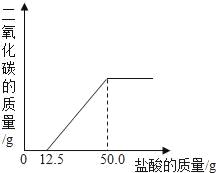
![]() 请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。______
请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。______