题目内容
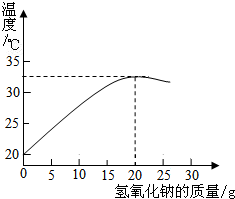
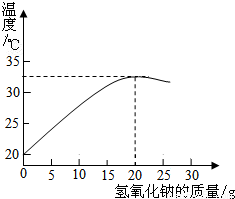
 32、右图表示质量分数为8%的氢氧化钠溶液与20g某浓度稀盐酸发生反应后溶液温度的变化情况.
32、右图表示质量分数为8%的氢氧化钠溶液与20g某浓度稀盐酸发生反应后溶液温度的变化情况.①根据曲线判断,当加入氢氧化钠溶液的质量为
15g
时,反应恰好完全进行.②当加入15g氢氧化钠溶液时,所得溶液中的溶质为
NaCl
(写化学式).③试计算该稀盐酸中溶质的质量分数(请写出计算过程).
分析:根据氢氧化钠与盐酸的反应进行分析,盐酸与氢氧化钠反应放出热量,二者恰好完全反应时放出的热量最多,当再加入氢氧化钠时,由于不再放出热量而氢氧化钠溶液的温度较低,溶液混合而导致温度下降,根据二者反应的化学方程式以及物质间的质量关系即可求得盐酸的溶质质量分数.
解答:解:①根据曲线可以看出,加入氢氧化钠溶液的质量为15g时二者恰好完全反应,所以本题答案为:15g;
②根据曲线可以看出,加入氢氧化钠溶液的质量为15g时二者恰好完全反应,依据NaOH+HCl═NaCl+H2O,故所得溶液的溶质为NaCl;
③解:设稀盐酸中溶质质量为x
NaOH+HCl═NaCl+H2O
40 36.5
15g*8% x
15g*8%:40=x:36.5,x=1.095g
HCl%=1.095g/20g*100%=5.475%
答:稀盐酸的溶质质量分数为5.475%.
故本题的答案为:
①15g②NaCl③5.475%.
②根据曲线可以看出,加入氢氧化钠溶液的质量为15g时二者恰好完全反应,依据NaOH+HCl═NaCl+H2O,故所得溶液的溶质为NaCl;
③解:设稀盐酸中溶质质量为x
NaOH+HCl═NaCl+H2O
40 36.5
15g*8% x
15g*8%:40=x:36.5,x=1.095g
HCl%=1.095g/20g*100%=5.475%
答:稀盐酸的溶质质量分数为5.475%.
故本题的答案为:
①15g②NaCl③5.475%.
点评:本题考查了氢氧化钠与盐酸的中和反应的有关计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

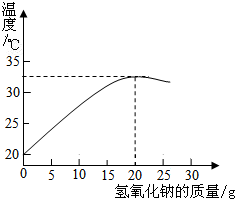 右图表示质量分数为8%的氢氧化钠溶液与20g某浓度稀盐酸发生反应后溶液温度的变化情况.
右图表示质量分数为8%的氢氧化钠溶液与20g某浓度稀盐酸发生反应后溶液温度的变化情况.