题目内容
在一定条件下,用普通铁粉和水蒸气反应,可以得到四氧化三铁,其反应的化学方程式为:3Fe+4H2O(气)
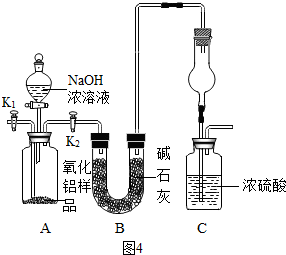
3Fe3o4+4H2.该Fe3O4又可以在加热条件下与氢气反应,生成颗粒很细的铁粉.这种很细的铁粉具有很高的反应活性,在空气中受到撞击或受热时会燃烧,俗称“引火铁”.请分别用图中示意的两套仪器装置(Ⅰ)和(Ⅱ),制取上述四氧化三铁和“引火铁”.实验中必须用到普通铁粉和稀盐酸,其它试剂自选(装置中必要的铁架台、铁圈、铁夹、石棉网、加热设备等在图中均已略去).
试填写下列空白:

(1)写出制取“引火铁”的化学方程式 .
(2)实验进行时试管A中应加入的试剂 ,烧瓶B的作用是 ,在试管D中收集得到的是 .
(3)实验时,U性管G中应加入的试剂是 ,长颈漏斗H中应加入的试剂是 .
(4)两套装置中,在实验时需要加热的仪器除A、E外,还有 .
(5)为了安全,在试管E中的反应发生前,在F出口处必须 .
| ||
试填写下列空白:

(1)写出制取“引火铁”的化学方程式
(2)实验进行时试管A中应加入的试剂
(3)实验时,U性管G中应加入的试剂是
(4)两套装置中,在实验时需要加热的仪器除A、E外,还有
(5)为了安全,在试管E中的反应发生前,在F出口处必须
考点:物质的相互转化和制备,金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;
(2)根据题中的反应原理和烧瓶的作用就是加热液体或者对液体进行蒸馏进行分析;
(3)为了方便加入稀盐酸使用了长颈漏斗,由于盐酸具有挥发性,所以在生成氢气的同时也会带出一部分水蒸气和氯化氢,需要碱性的固体干燥剂进行干燥;
(4)从实验所要达到的目的可以看出,前一个装置是完成第一步实验的,而后一个装置是完成第二步实验的,所以装置E需要加热;
(5)根据氢气是可燃性气体,在做其性质实验时要保证氢气的纯度进行分析.
(2)根据题中的反应原理和烧瓶的作用就是加热液体或者对液体进行蒸馏进行分析;
(3)为了方便加入稀盐酸使用了长颈漏斗,由于盐酸具有挥发性,所以在生成氢气的同时也会带出一部分水蒸气和氯化氢,需要碱性的固体干燥剂进行干燥;
(4)从实验所要达到的目的可以看出,前一个装置是完成第一步实验的,而后一个装置是完成第二步实验的,所以装置E需要加热;
(5)根据氢气是可燃性气体,在做其性质实验时要保证氢气的纯度进行分析.
解答:解:(1)依据装置和实验目的分析,制取“引火铁”的反应是氢气和四氧化三铁在加热的条件下生成铁和水,化学方程式为:Fe3O4+4H2
3Fe+4H2O;
(2)依据题干中所提供的物质可以推断出第一步实验中除了生成四氧化三铁外还会生成氢气,发生的反应为铁在高温和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
4H2+Fe3O4,试管A是铁与水蒸气反应的装置,所以在A中装的应该是:普通铁粉,在反应过程中要生成氢气,所以D是用来收集氢气的,烧瓶的作用就是加热液体或者对液体进行蒸馏,所以这里蒸馏瓶所起的作用就是产生水蒸气,所以实验进行时试管A中应加入的试剂:普通铁粉,烧瓶B的作用是:提供水蒸气,在试管D中收集得到的是:氢气;
(3)装置I是用来制取氢气的装置,所以装置H是用来添加盐酸的,F中发生反应:Fe3O4+4H2
3Fe+4H2O,由于使用的是稀盐酸来制取氢气,所以在产生氢气的同时可能带出部分水蒸气和氯化氢气体,所以在U型管中加入固体来干燥气体,吸收氯化氢和水蒸气,所以U型管中为碱石灰等碱性固体干燥剂,所以实验时,U性管G中应加入的试剂是:碱石灰,长颈漏斗H中应加入的试剂是:稀盐酸;
(4)通过题中的反应可以看出,B是提供水蒸气的,所以两套装置中,在实验时需要加热的仪器除A、E外,还有:B;
(5)氢气是可燃性气体,做氢气的性质实验时必须保证氢气是纯净的,为了安全,在E管中的反应发生前,在F出口处必须进行气体验证纯度,E管中的反应开始后,在F出口处应点燃氢气,避免排放到空气中遇火爆炸,所以为了安全,在试管E中的反应发生前,在F出口处必须:检验气体的纯度,对气体点燃或收集.
故答案为:(1)Fe3O4+4H2
3Fe+4H2O;
(2)普通铁粉,提供水蒸气,氢气;
(3)碱石灰,稀盐酸;
(4)B;
(5)检验气体的纯度,对气体点燃或收集.
| ||
(2)依据题干中所提供的物质可以推断出第一步实验中除了生成四氧化三铁外还会生成氢气,发生的反应为铁在高温和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
| ||
(3)装置I是用来制取氢气的装置,所以装置H是用来添加盐酸的,F中发生反应:Fe3O4+4H2
| ||
(4)通过题中的反应可以看出,B是提供水蒸气的,所以两套装置中,在实验时需要加热的仪器除A、E外,还有:B;
(5)氢气是可燃性气体,做氢气的性质实验时必须保证氢气是纯净的,为了安全,在E管中的反应发生前,在F出口处必须进行气体验证纯度,E管中的反应开始后,在F出口处应点燃氢气,避免排放到空气中遇火爆炸,所以为了安全,在试管E中的反应发生前,在F出口处必须:检验气体的纯度,对气体点燃或收集.
故答案为:(1)Fe3O4+4H2
| ||
(2)普通铁粉,提供水蒸气,氢气;
(3)碱石灰,稀盐酸;
(4)B;
(5)检验气体的纯度,对气体点燃或收集.
点评:在解此类题时,首先分析题中的反应原理,然后找出对应的学过的知识点,然后结合题中所给的知识进行解答.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目