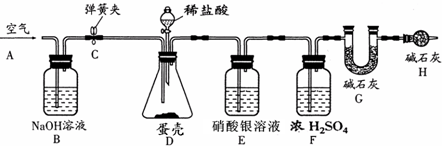
题目内容
某实验小组欲测定某白色粉末(已知是碳酸钠与碳酸氢钠的混合物)的组成,取三份质量不同的样品甲、乙、丙分别与30g稀盐酸充分反应,得到的常温常压下气体体积关系如下表,试求:
(1)样品中碳酸钠的质量分数?
(2)稀盐酸的质量分数?(已知二氧化碳常温常压下的密度是1.97g/L)(计算过程中保留两位小数)
(1)样品中碳酸钠的质量分数?
(2)稀盐酸的质量分数?(已知二氧化碳常温常压下的密度是1.97g/L)(计算过程中保留两位小数)
| 甲 | 乙 | 丙 | |
| 混合物质量/g | 3.80 | 7.60 | 11.4 |
| 二氧化碳的体积/L | 0.893 | 1.786 | 1.786 |
(1)由表分析可知,第二次反应恰好完全反应,第二次反应生成的二氧化碳质量为1.786g×1.97g/L=3.52g
设7.60克混合物中含碳酸钠质量为x.生成的二氧化碳质量为y,则7.60克混合物中含碳酸氢钠质量为7.60g-x.生成的二氧化碳质量为3.52g-y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
7.6g-x 3.52g-y
得方程组:
得:x=4.24g y=1.76g
所以碳酸钠的质量分数为:
×100%=55.79%
答:样品中碳酸钠的质量分数为55.79%
(2)设7.60克混合物中碳酸钠消耗的HCl质量为a,碳酸氢钠消耗的HCl质量为b
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
4.24g a
=
解之得:a=2.92g
NaHCO3+HCl=NaCl+H2O+CO2↑
84 36.5
3.36g b
=
解之得 b=1.46g
所以盐酸的质量分数为:
×100%=14.60%
答:稀盐酸的质量分数为14.60%
设7.60克混合物中含碳酸钠质量为x.生成的二氧化碳质量为y,则7.60克混合物中含碳酸氢钠质量为7.60g-x.生成的二氧化碳质量为3.52g-y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
7.6g-x 3.52g-y
得方程组:
|
得:x=4.24g y=1.76g
所以碳酸钠的质量分数为:
| 4.24g |
| 7.60g |
答:样品中碳酸钠的质量分数为55.79%
(2)设7.60克混合物中碳酸钠消耗的HCl质量为a,碳酸氢钠消耗的HCl质量为b
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
4.24g a
| 106 |
| 73 |
| 4.24g |
| a |
解之得:a=2.92g
NaHCO3+HCl=NaCl+H2O+CO2↑
84 36.5
3.36g b
| 84 |
| 36.5 |
| 3.36g |
| b |
解之得 b=1.46g
所以盐酸的质量分数为:
| 2.92g+1.46g |
| 30g |
答:稀盐酸的质量分数为14.60%

练习册系列答案
相关题目