题目内容
有下列A-F六种装置供选用,如图.

(1)实验室制取并收集氧气时,应选择 和 相连接;制取并收集氢气时,应选择 和 相连接.
(2)制取氢气并用氢气还原氧化铜实验时,应选择 和 相连接.
(3)试管中已放好氧化铜并固定在铁架台上,应先 再 ,实验完毕应先 ,再 ,注意B装置中的长颈漏斗管口一定要 ,否则 .

(1)实验室制取并收集氧气时,应选择
(2)制取氢气并用氢气还原氧化铜实验时,应选择
(3)试管中已放好氧化铜并固定在铁架台上,应先
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,氢气的制取和检验,氢气的化学性质与燃烧实验
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)实验室可以利用加热高锰酸钾或氯酸钾的方法制取氧气,也可以利用过氧化氢制取氧气;
氧气的密度比空气的密度大,不易溶于水;
通常情况下,锌和稀硫酸反应生成硫酸锌和氢气,氢气难溶于水,密度比空气小;
(2)利用B装置可以制取氢气,利用D装置可以还原氧化铜;
(3)可燃性的氢气与空气混合达到一定程度,即达到氢气的爆炸极限时,遇明火或加热时会发生爆炸;
铜在高温条件下,能被空气中的氧气氧化;
为了防止气体从长颈漏斗逸出,长颈漏斗末端应该浸没在液面以下.
氧气的密度比空气的密度大,不易溶于水;
通常情况下,锌和稀硫酸反应生成硫酸锌和氢气,氢气难溶于水,密度比空气小;
(2)利用B装置可以制取氢气,利用D装置可以还原氧化铜;
(3)可燃性的氢气与空气混合达到一定程度,即达到氢气的爆炸极限时,遇明火或加热时会发生爆炸;
铜在高温条件下,能被空气中的氧气氧化;
为了防止气体从长颈漏斗逸出,长颈漏斗末端应该浸没在液面以下.
解答:解:(1)实验室利用高锰酸钾或氯酸钾制取氧气时需要加热,应该用A装置作为发生装置;
实验室利用过氧化氢制取氧气时不需要加热,应该用B装置作为发生装置;
因为氧气的密度比空气大,可以用向上排空气法收集,即用E装置收集,氧气不易溶于水,可以用排水法收集,即用C装置收集;
实验室制取氢气时不需要加热,应该用B装置作为发生装置;
氢气难溶于水,可以用排水法收集,即用C装置收集,密度比空气小,可以用向下排空气法收集,即用F装置收集.
故填:A或B;C或E;B;C或F.
(2)制取氢气并用氢气还原氧化铜实验时,应选择B和D相连接.
故填:B;D.
(3)试管中已放好氧化铜并固定在铁架台上,应先通入一会儿氢气再加热,这样可以防止发生爆炸;
实验完毕应先停止加热,再继续通氢气至试管冷却,这样可以防止铜被空气中的氧气氧化;
B装置中的长颈漏斗管口一定要浸没在液面以下,否则氢气会从长颈漏斗逸出.
故填:通入一会儿氢气;加热;停止加热;继续通氢气至试管冷却;浸没在液面以下;氢气会从长颈漏斗逸出.
实验室利用过氧化氢制取氧气时不需要加热,应该用B装置作为发生装置;
因为氧气的密度比空气大,可以用向上排空气法收集,即用E装置收集,氧气不易溶于水,可以用排水法收集,即用C装置收集;
实验室制取氢气时不需要加热,应该用B装置作为发生装置;
氢气难溶于水,可以用排水法收集,即用C装置收集,密度比空气小,可以用向下排空气法收集,即用F装置收集.
故填:A或B;C或E;B;C或F.
(2)制取氢气并用氢气还原氧化铜实验时,应选择B和D相连接.
故填:B;D.
(3)试管中已放好氧化铜并固定在铁架台上,应先通入一会儿氢气再加热,这样可以防止发生爆炸;
实验完毕应先停止加热,再继续通氢气至试管冷却,这样可以防止铜被空气中的氧气氧化;
B装置中的长颈漏斗管口一定要浸没在液面以下,否则氢气会从长颈漏斗逸出.
故填:通入一会儿氢气;加热;停止加热;继续通氢气至试管冷却;浸没在液面以下;氢气会从长颈漏斗逸出.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
 (1)某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则x为
(1)某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则x为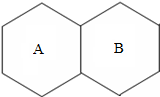 现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:(已知金属钡的金属活动性在钾和钙之间)
现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:(已知金属钡的金属活动性在钾和钙之间)