题目内容
有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、NaCl、Na2SO4、(NH4)2CO3中的一种或几种,为证明其组成进行如下实验:
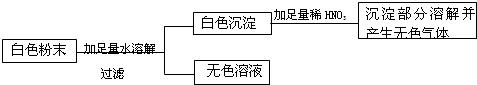
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是______,原混合物中一定不含有______;
(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀部分溶解,并产生无色气体,则原
混合物中一定含有______;
(3)向实验(1)的滤液中加入足量的氢氧化钠溶液,有剌激性气味气体放出,证明实验(1)的白色沉淀一定有______;
(4)向实验(3)后的溶液中加入稀硝酸酸化,再加入足量的硝酸钡,发现没有沉淀产生,然后加入硝酸银溶液,出现了白色沉淀,有人由此得出原混合物中一定含的氯化钠,你认为______(填“正确”“不正确”),理由______.
(5)实验结论是______.
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是______,原混合物中一定不含有______;
(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀部分溶解,并产生无色气体,则原
混合物中一定含有______;
(3)向实验(1)的滤液中加入足量的氢氧化钠溶液,有剌激性气味气体放出,证明实验(1)的白色沉淀一定有______;
(4)向实验(3)后的溶液中加入稀硝酸酸化,再加入足量的硝酸钡,发现没有沉淀产生,然后加入硝酸银溶液,出现了白色沉淀,有人由此得出原混合物中一定含的氯化钠,你认为______(填“正确”“不正确”),理由______.
(5)实验结论是______.
(1)碳酸钙不溶于水,钡离子和碳酸根离子、硫酸根离子会生成碳酸钡沉淀和硫酸钡沉淀,所以白色沉淀可能是一种或多种,故答案为:CaCO3、BaCO3、BaSO4,
沉淀是白色、滤液是无色,铜离子在溶液中显蓝色,故答案为:CuSO4,
(2)碳酸钙沉淀和碳酸钡沉淀都会溶于酸,硫酸钡沉淀不溶于酸,白色沉淀中加入足量的盐酸,沉淀部分溶解,并产生无色气体,所以沉淀中一定有硫酸钡(没有溶解的那部分),故答案为:BaCl2、Na2SO4,
(3)混合物中的物质和氢氧化钠反应会生成刺激性气体的,只有碳酸铵,碳酸根离子就会与钡离子生成碳酸钡沉淀,故答案为:BaCO3,
(4)虽然加入硝酸银会生成氯化银沉淀,但是氯离子是原来就有的,还是反应引入的不能确定,故答案为:不正确,因为BaCl2与Na2SO4反应会生成NaCl,
(5)根据(1)中的现象可以确定一定不存在硫酸铜,根据(2)中的现象可以确定一定存在氯化钡和硫酸钠,根据(3)中的现象知道一定存在碳酸铵,(4)中的现象不能确定氯化钠的存在.故答案为:一定有BaCl2、Na2SO4、(NH4)2CO3,一定无CuSO4,可能有NaCl、CaCO3.
沉淀是白色、滤液是无色,铜离子在溶液中显蓝色,故答案为:CuSO4,
(2)碳酸钙沉淀和碳酸钡沉淀都会溶于酸,硫酸钡沉淀不溶于酸,白色沉淀中加入足量的盐酸,沉淀部分溶解,并产生无色气体,所以沉淀中一定有硫酸钡(没有溶解的那部分),故答案为:BaCl2、Na2SO4,
(3)混合物中的物质和氢氧化钠反应会生成刺激性气体的,只有碳酸铵,碳酸根离子就会与钡离子生成碳酸钡沉淀,故答案为:BaCO3,
(4)虽然加入硝酸银会生成氯化银沉淀,但是氯离子是原来就有的,还是反应引入的不能确定,故答案为:不正确,因为BaCl2与Na2SO4反应会生成NaCl,
(5)根据(1)中的现象可以确定一定不存在硫酸铜,根据(2)中的现象可以确定一定存在氯化钡和硫酸钠,根据(3)中的现象知道一定存在碳酸铵,(4)中的现象不能确定氯化钠的存在.故答案为:一定有BaCl2、Na2SO4、(NH4)2CO3,一定无CuSO4,可能有NaCl、CaCO3.

练习册系列答案
相关题目
(1)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,经实验得到下表,请完成相关内容.
(2)某化学兴趣小组为测定该包白色粉末中碳酸钠的质量分数,取该样品44.6g,加286.2克水溶解制成溶液后投入146克稀盐酸中完全反应,共收集到二氧化碳气体8.8g.求:(1)该碳酸钠样品中碳酸钠的质量分数;(2)反应所得溶液中溶质的质量分数.
| 实验步骤及现象 | 结论 |
| ①将少许白色粉末溶于水得到无色溶液A | 白色粉末中一定没有 |
| ②在A中加入足量硝酸钡溶液,生成白色沉淀B,过滤得滤液C ③在白色沉淀B中加入足量稀硝酸, ④在滤液C中加入硝酸银溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解. |
白色粉末中一定有 碳酸钠和氯化钠 |
 (2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )
(2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )