题目内容
在3%的H2O2溶液中,氢元素的质量分数为
11.0%
11.0%
,当H2O2制取氧气完全分解后,液体中氢元素的质量分数增加0.1
0.1
%.(保留到小数点后l位)分析:g过氧化氢溶液的溶质和溶剂里都含有氢元素,可先假设溶液质量为100g,分别计算出H2O2和H2O中H元素的质量,再根据氢元素的质量分数=
×100%计算即可;
根据双氧水分解的化学方程式可知,当双氧水完全分解时,气体逸出,溶液质量减少,此时溶液中氢元素的质量不变,原溶液的质量减去生成气体的质量就是反应后溶液质量,再根据反应后氢元素的质量分数=
×100%,两个质量分数之差就是液体中氢元素的质量分数增加的数值.
| 过氧化氢和水中氢元素的质量和 |
| 过氧化氢溶液的质量 |
根据双氧水分解的化学方程式可知,当双氧水完全分解时,气体逸出,溶液质量减少,此时溶液中氢元素的质量不变,原溶液的质量减去生成气体的质量就是反应后溶液质量,再根据反应后氢元素的质量分数=
| 氢元素的质量 |
| 溶液的质量 |
解答:解:设过氧化氢溶液的总质量为100g,则双氧水(H2O2)为×3%=3g,水(H2O)100g-3g=为97g,
∴溶液中氢元素的质量为:3g×
×100%+97g×
×100%=10.98g
∴溶液中氢元素的质量分数为
×100%=10.98%≈11.0%;
设3克过氧化氢分解生成O2质量为x,
2H2O2
2H2O+O2↑
68 32
3g x
=
解之得:x≈1.41g
×100%≈11.1%,
∴液体中的氢元素的质量分数增加11.1%-11.0%=0.1%.
故答案为:11.0%;0.1
∴溶液中氢元素的质量为:3g×
| 2 |
| 34 |
| 2 |
| 18 |
∴溶液中氢元素的质量分数为
| 10.98g |
| 100g |
设3克过氧化氢分解生成O2质量为x,
2H2O2
| ||
68 32
3g x
| 68 |
| 3g |
| 32 |
| x |
解之得:x≈1.41g
| 10.98g |
| 100g-1.41g |
∴液体中的氢元素的质量分数增加11.1%-11.0%=0.1%.
故答案为:11.0%;0.1
点评:了解溶质质量分数的计算方法,并能结合具体化学反应进行分析是解答此题的关键.

练习册系列答案
相关题目
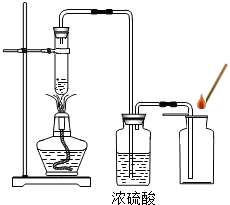 某学校化学兴趣小组同学在学习了制取氧气这一节内容后,发现在实验室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是
某学校化学兴趣小组同学在学习了制取氧气这一节内容后,发现在实验室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是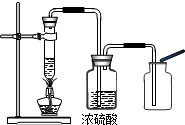 之一是
之一是