题目内容
【题目】某腐蚀印刷电路板的废液中含有CuCl2和FeCl2 , 为了分析该废液的组成,取1000g废液,设计如下实验方案进行探究: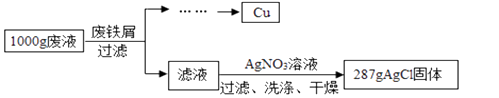
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
废铁屑的质量/g | 20 | 40 | 60 | 80 |
析出Cu的质量/g | 12.8 | 25.6 | 32 | 32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1000g废液与足量废铁屑完全反应,析出Cu的质量为 g。
(2)废铁屑中单质Fe的质量分数为。
(3)计算1000g废液中CuCl2的质量分数。(写出计算过程,结果保留小数点后一位)
(4)1000g废液中FeCl2的质量分数为。(结果保留小数点后一位)
【答案】
(1)32g
(2)56%
(3)6.8%
(4)6.4%
【解析】(1)从表格看:1000 g废液与足量废铁屑完全反应,析出Cu的质量为32克;
(2)从前两组数据看,废铁屑20克可以恰好得到12.8克的铜单质,设生成12.8克的铜需要的铁的质量为X,
Fe+CuCl2=FeCl2+ | Cu |
56 | 64 |
x | 12.8g |
列比例式得: ![]()
X=11.2g 废铁屑中单质Fe的质量分数为=11.2克÷20克×100%=56%;
(3)设1000 g废液中CuCl2的质量为X,同时生成的氯化亚铁的质量为Y,
Fe+ | CuCl2= | FeCl2+ | Cu |
135 | 127 | 64 | |
x | y | 32g |
列比例式得: ![]()
求得X=67.5g Y=63.5g计算1000 g废液中CuCl2的质量分数=67.5克/1000克×100%=6.8%;
(4)设溶液中FeCl2的质量为X,
FeCl2+2AgNO3= | 2AgCl↓+ Fe(NO3)2 |
127 | 287 |
x | 287g |
列比例式得 ![]()
求得X=127g 则废液中的氯化亚铁的质量为=127克-63.5克=63.5克,
1000 g废液中FeCl2的质量分数为=63.5克÷1000克×100%=6.4%.
故答案为:(1)32g;(2)56%;(3)6.8%;(4)6.4%.
(1)根据表中的数据进行分析;
(2)根据加入20g的废铁屑会生成12.8克的铜进行分析;
(3)根据表中的数据可以看出,生成的铜是32克,然后结合化学方程式进行计算;
(4)根据氯化亚铁和硝酸银反应生成硝酸亚铁和氯化银沉淀,结合生成沉淀的量进行解答.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铜是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。
【提出问题】氧化铜能不能作过氧化氢分解的催化剂呢?
【作出猜想】氧化铜能作过氧化氢分解的催化剂。
【实验验证】
实验步骤 | 实验现象 | 实验结论 | |
实验一 | ① | 有少量气泡 | 常温下过氧化氢溶液分解速率很慢。 |
实验二 | 在装有过氧化氢溶液的试管中加入少量氧化铜,然后将带火星的木条伸入试管中。 | 产生大量的气泡 | ② |
【得出结论】氧化铜能加快过氧化氢的分解速率,故氧化铜能作过氧化氢分解的催化剂。
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明氧化铜能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
[实验目的]探究。
[实验步骤]①准确称量氧化铜(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤, , 称量;④对比反应前后氧化铜的质量。
[交流讨论]如果氧化铜在反应前后质量不变,则说明氧化铜可以作过氧化氢分解的催化剂。
【提出新的问题】小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验探究。