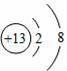
题目内容
元素周期律和周期表是学习化学的重要工具,如表是元素周期表的部分信息.请认真分析表中信息,回答下列问题:


(1)铝原子的最外层电子数是 .核电荷数为12的元素符号是 .
(2)原子序数为8和14的元素组成化合物的化学式 .
(3)11号元素的原子在化学反应中比较容易 (填“得到”或“失去”)电子,该元素属于 (填“金属”或“非金属”)元素.
(4)第三周期的元素的共同点是 ;上述元素在周期表中处于同一周期的原因 .
(5)在同一周期中,从左到右各元素的原子最外层电子数逐渐 .
(6)从上表,我们还可以发现一些规律 (写一条即可)
【考点】元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
【专题】元素位置、结构与性质;化学用语和质量守恒定律.
【分析】(1)原子序数=核电荷数=核内质子数,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,据此进行分析解答.
(2)根据质子数确定元素种类,根据元素化合价书写化学式.
(3)原子序数为11的原子是钠原子,钠原子最外层电子数为1,据此进行分析解答.
(4)根据元素周期表的元素周期律进行分析解答.
(5)根据元素周期表的元素周期律进行分析解答.
(6)根据元素周期律及图表中的信息进行分析解答.
【解答】解:(1)由原子的结构示意图可知,其原子最外层有3个电子;核电荷数为12的元素符号是Mg;故填:3;Mg.
(2)原子序数为8和14的元素其主要化合价为﹣2和+4,所以其组成化合物的化学式为:SiO2.故填:SiO2.
(3)原子序数为11的元素是钠元素,属于金属元素,其原子结构最外层有1个电子,在化学反应中易失去最外层的电子;故填:失去;金属.
(4)认真分析表中信息可知,第三周期的元素的共同点是同一周期元素最外层电子数从左到右逐渐增多;上述元素在周期表中处于同一周期的原因是电子层数相同;故填:同一周期元素最外层电子数逐渐增多; 电子层数相同.
(5)根据元素周期表的元素周期律进行分析,在同一周期中,从左到右各元素的原子最外层电子数逐渐增加,故填:增加.
(6)根据元素周期律及图表中的信息可总结:
电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;同一周期原子的最外层电子数从左到右逐渐增加;从左至右元素的排布规律为金属元素→非金属元素→稀有气体元素;
故填:从左至右元素的排布规律为金属元素→非金属元素→稀有气体元素.
【点评】本题难度不大,考查学生灵活运用元素周期表中元素的信息、粒子结构示意图的含义等进行分析、解题的能力;本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.

海水是人类的资源宝库,从海水中可获得多种产品。
(一)海水可以晒盐,得到粗盐。提纯含有泥沙的粗盐,一般要经过一下操作流程:
 |


 (1)海水晒盐是利用了_____________结晶的原理。
(1)海水晒盐是利用了_____________结晶的原理。
(2)操作①的目的是_____________________________________,该操作必须用到的一种仪器是______
A.量筒 B.研钵 C.玻璃棒 D.试管
(3)操作④的名称是_________。
(4)操作⑤中为减少食盐固体飞溅,需要___________________________________。
(5)操作③④⑤都要用到的仪器是___________,其中操作④中该仪器的作用是_________________。
(6)实验结束后称量获得的精盐,计算产率发现偏低,可能的原因是___________
A.食盐没有全部溶解 就过滤 B.蒸发时食盐飞溅
就过滤 B.蒸发时食盐飞溅
C.蒸发后得到的食盐很潮湿 D.蒸发皿上沾有的精盐没有全部转移到称量纸上
 (二)提取金属镁:制取粗盐后的苦卤中含有丰富MgCl2等资源,下图是从苦卤中提取镁的简单流程:
(二)提取金属镁:制取粗盐后的苦卤中含有丰富MgCl2等资源,下图是从苦卤中提取镁的简单流程:
上述流程中,试剂A通常用廉价的 (填化学式)悬浊液,沉淀B是  ,试剂C为 ,由无水MgCl2制取Mg的化学方程式为 。
,试剂C为 ,由无水MgCl2制取Mg的化学方程式为 。

 B.
B.
 C.
C.
 D.
D.






 、
、
 的粒子,表示了同种元素不同的粒子
的粒子,表示了同种元素不同的粒子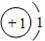
 B.
B.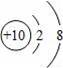
 C.
C.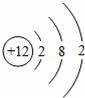
 D.
D.