题目内容
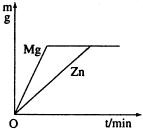
把一定质量的锌和镁分别投入足量的稀盐酸中,充分反应后,生成
H2的质量关系如图所示(图中m表示氢气的质量,t表示反应时间),则投入的锌与镁的质量比是
[ ]
|
A.1∶1 |
B.24∶65 |
|
C.65∶24 |
D.无法确定 |
答案:C
提示:
提示:
|
点悟:由图知,锌与镁分别与稀盐酸反应时,产生 H2的质量随时间的增加而增加,但一定时间后,锌、镁与稀盐酸反应产生H2的质量不再随时间的变化而改变,说明稀盐酸足量时,锌与镁完全反应,并产生等质量的H2.由化学方程式:Zn+2HCl=ZnCl2+H2↑;Mg+2HCl=MgCl2+H2↑ 65 2 24 2 知,得等质量 H2时,锌需消耗65份质量而镁需消耗24份质量,因此,投入锌和镁的质量比为65∶24. |

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
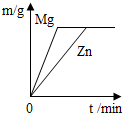 把一定质量的锌和镁分别投入足量的稀盐酸中,充分反应后,生成氢气的质量关系如图所示(图中m表示氢气的质量,t表示反应时间),则投入的锌和镁的质量比是( )
把一定质量的锌和镁分别投入足量的稀盐酸中,充分反应后,生成氢气的质量关系如图所示(图中m表示氢气的质量,t表示反应时间),则投入的锌和镁的质量比是( )| A、1:1 | B、24:65 | C、65:24 | D、无法确定 |