题目内容
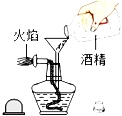
工业上以氨气为原料制备硝酸的过程(见图1)如下:
某课外小组认真分析了工业制取硝酸的流程及反应原理,设计了如图2的实验装置制备硝酸,试回答下列相关问题:
①完成图1工业上用氨气制取NO的化学方程式:4NH3+5O2═4NO+6 ;然后产生的NO被氧气氧化成NO2;NO2和水反应生成硝酸和NO.
②连接好图2装置后,首先进行的操作是 .
③图2中通入的气体a是 ,其目的是 .
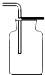
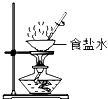
④盛有Na2CO3溶液的烧杯作为尾气处理装置有点缺陷,某兴趣小组把图2右边装置改进成如图3的装置,这样改进的优点是 .
【分析】①根据质量守恒定律,化学反应前后原子的种类和数目不变解答;
②根据实验前应先检验装置的气密性解答;
③根据为提高NO2的转化率,可以通入氧气解答;
④根据可以防止倒吸或充分吸收有害气体解 答.
答.
【解答】解:①根据质量守恒定律,化学反应前后原子的种类和数目不变,工业上用氨气制取NO的化学方程式是:4NH3+5O2═4NO+6H2O;
②连接好图3该装置后,首先进行的操作检查装置气密性;
③为提高NO2的转化率,可以通入氧气;
④盛有Na2CO3溶液的烧杯作为尾气处理装置有点缺陷,需在该装置导管口末端加一个倒扣漏斗,这样改进的优点是防止倒吸或充分吸收有害气体.
故答案为:①H2O;
②检查装置的气密性.
③氧气,提高NO2的转化率.
④防止倒吸或者充分吸收有害气体.

练习册系列答案
相关题目
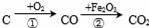

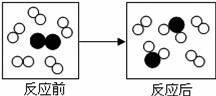

 ”和“
”和“ ”变化的微观示意图.图中分别表示两种元素的原子,能用该图示表示的化学反应是
”变化的微观示意图.图中分别表示两种元素的原子,能用该图示表示的化学反应是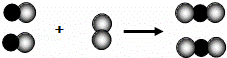
 2H2O B.CO2+H2O
2H2O B.CO2+H2O