题目内容
4.下列除杂试剂及操作方法均使用正确的是( )| 选项 | 物质 | 杂质 | 操作方法 |
| A | Cu | Fe | 加过量的盐酸,过滤 |
| B | CaCl2溶液 | HCl | 加入过量CaCO3后过滤 |
| C | CO2 | CO | 碱石灰(CaO和 NaOH 的混合物) |
| D | NaOH 溶液 | Ca(OH)2 | 适量K2CO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、Fe能与过量的盐酸反应生成氯化亚铁溶液和氢气,Cu不与稀盐酸反应,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
B、HCl能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
C、CO2能与碱石灰中的氢氧化钠反应生成碳酸钠和水,一氧化碳不与CaO和NaOH反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
D、Ca(OH)2能与适量K2CO3 溶液反应生成碳酸钙沉淀和氢氧化钾,能除去杂质但引入了新的杂质氢氧化钾,不符合除杂原则,故选项所采取的方法错误.
故选:AB.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
14.下列物质在盛有空气的密闭容器中燃烧,能除去氧气得到较为纯净的氮气的是( )
| A. | 木炭 | B. | 细铁丝 | C. | 红磷 | D. | 石蜡 |
19.四位同学分别用下列四种方法检验NaOH溶液是否已变质含有Na2CO3,
(1)加少量稀盐酸,无气泡放出,则一定不含Na2CO3
(2)加少量澄清石灰水,有沉淀生成,则一定含有Na2CO3
(3)加少量CaCl2溶液,有沉淀生成,则一定含有Na2CO3
(4)加少量BaCl2溶液有沉淀生成,则一定含有Na2CO3,
其中方法和结论都正确的是( )
(1)加少量稀盐酸,无气泡放出,则一定不含Na2CO3
(2)加少量澄清石灰水,有沉淀生成,则一定含有Na2CO3
(3)加少量CaCl2溶液,有沉淀生成,则一定含有Na2CO3
(4)加少量BaCl2溶液有沉淀生成,则一定含有Na2CO3,
其中方法和结论都正确的是( )
| A. | (1)(2) | B. | (1)(2)(3) | C. | (2)(3)(4) | D. | (1)(2)(3)(4) |
13.以下是某研究小组探究影响反应速率部分因素的相关实验数据.
(1)通过实验①和②对比可知,化学反应速率与浓度有关;
(2)从实验③和④对比可知,化学反应速率与温度的关系是:温度越高,化学反应速率越快;
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量不变. 在此反应中MnO2起催化作用.
(4)该研究小组探究影响反应速率部分因素实验中采用了控制变量的方法.
| 实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 无 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 无 | 2 | 10.76 |
(2)从实验③和④对比可知,化学反应速率与温度的关系是:温度越高,化学反应速率越快;
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量不变. 在此反应中MnO2起催化作用.
(4)该研究小组探究影响反应速率部分因素实验中采用了控制变量的方法.
14.下列是日常生活中常发生的一些变化,其中都属于化学变化的一组是( )
| A. | 水沸腾、酒精燃烧 | B. | 汽油挥发、动植物的呼吸 | ||
| C. | 剩饭变馊、铁锅生锈 | D. | 锅炉爆炸、燃放鞭炮 |
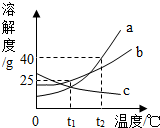 如图,a、b、c三种固体物质的溶解度变化如图所示.
如图,a、b、c三种固体物质的溶解度变化如图所示.