题目内容
1.实验室制取气体时所需的一些装置如图1所示,请回答下列问题: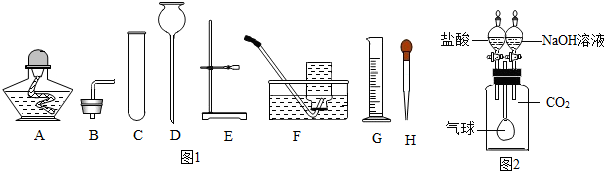
(1)实验室用氯酸钾和二氧化锰制取氧气,该反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,其气体发生装置可选择图1中的ABCE(填标号)组合.
(2)实验室也可以用双氧水来制取氧气,实验时还需加入少量二氧化锰,MnO2在该反应中可以重复使用,理由是.现要配制100g溶质质量分数为6%的双氧水溶液,需要30%的双氧水溶液20g,需要加入水的体积为80mL.
(3)利用如图2所示装置来验证二氧化碳气体的性质,要证明二氧化碳气体与氢氧化钠能够发生反应,加入试剂的顺序是先加氢氧化钠溶液,然后滴加盐酸,气球的变化是气球先变大后变小.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.有关溶液的稀释问题,抓住溶液中溶质的质量不变;利用如图2所示装置来验证二氧化碳气体的性质,要证明二氧化碳气体与氢氧化钠能够发生反应,加入试剂的顺序是:先加氢氧化钠溶液,然后滴加盐酸,二氧化碳被氢氧化钠溶液吸收生成碳酸钠和水,瓶内压强变小,气球变大;再滴加盐酸,碳酸钠与盐酸反应生成氯化钠和水和二氧化碳,瓶内压强变大,气球变小.
解答 解:(1)氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,发生装置可选择图1中的ABCE;故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;ABCE;
(2)设需要30%的双氧水溶液的质量为x,x•30%=100g×6%,x=20g,水的质量=100g-20g=80g,V=$\frac{m}{ρ}$=$\frac{80g}{1.0g/mL}$=80mL;
故答案为:20;80;
(3)利用如图2所示装置来验证二氧化碳气体的性质,要证明二氧化碳气体与氢氧化钠能够发生反应,加入试剂的顺序是:先加氢氧化钠溶液,然后滴加盐酸,二氧化碳被氢氧化钠溶液吸收生成碳酸钠和水,瓶内压强变小,气球变大;再滴加盐酸,碳酸钠与盐酸反应生成氯化钠和水和二氧化碳,瓶内压强变大,气球变小;故答案为:先加氢氧化钠溶液,然后滴加盐酸;气球先变大后变小;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、二氧化碳的性质和有关溶液的计算等,综合性比较强,有关的计算要准确.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案| A. | 化学性质与水不同 | |
| B. | 分子不再运动 | |
| C. | 氢、氧两种原子的个数比为2:1 | |
| D. | 分子间的间隔比普通的液态水(0一100℃)的大 |
| A. | 二氧化碳气体能使干燥的紫色石蕊纸花变红色 | |
| B. | 充满二氧化碳气体气体的集气瓶,盖好玻璃片后应正放在桌面上 | |
| C. | 碳和氧气都是非金属单质,都具有可燃性 | |
| D. | 浓硫酸和氢氧化钠固体都能吸收空气中水分,因此都可用来干燥二氧化碳气体 |
| A. | H2 | B. | O | C. | C60 | D. | S |
 小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.
小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.【第一组实验】检验该双氧水是否失效.
(1)实验过程
①在试管中加入5mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如图装置进行操作,带火星的木条复燃,水槽中冰水所起让水蒸汽冷凝的作用.
(2)实验结论:双氧水没有失效.
【第二组实验探究】:氧化铜(CuO)能否催化“双氧水”分解
[猜想]Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后质量和化学性质不变.
[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验:

(3)完成下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中有气泡冒出, 带火星的木条复燃 | 仍为0.2g (氧化铜质量不变) | 溶液中有气泡放出, 使带火星木条复燃 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立 |
(5)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、玻璃棒.
(6)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是D(填序号).

(7)步骤⑦的目的检验氧化铜化学性质是否改变.
(8)过氧化氢能被CuO催化分解放出O2的反应表达式为2H2O2$\frac{\underline{\;CuO\;}}{\;}$2H2O+O2↑.
 如图是A、B两种固体物质的溶解度曲线.
如图是A、B两种固体物质的溶解度曲线.