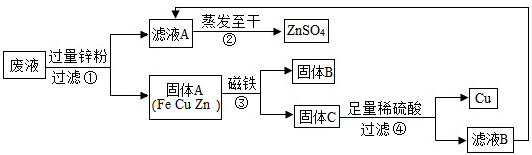
题目内容
25、水污染.于是几位同学利用课余时间处理废液,回收工业重要原料ZnSO4和有关金属.实验过程如下:

请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是
(2)写出步骤①其中一个反应的化学方程式
(3)步骤①加入的锌粉为什么要过量,请简要说理由
(4) 在实验室进行步骤②的操作,需要把滤液倒入

请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是
硫酸锌
;固体B的化学式为
Fe
.(2)写出步骤①其中一个反应的化学方程式
Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe)
.(3)步骤①加入的锌粉为什么要过量,请简要说理由
确保废液中的铁离子和铜离子完全反应
.(4) 在实验室进行步骤②的操作,需要把滤液倒入
蒸发皿
(填仪器名称)中;操作过程中用玻璃棒搅拌的目的是
使溶液均匀受热,防止液滴飞溅
;在
蒸发皿中出现较多固体
时,停止加热.分析:金属和盐溶液发生置换反应必须具备:在金属活动性顺序中,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,钾、钙、钠除外;金属和酸溶液发生置换反应生成氢气必须具备:金属应是在金属活动性顺序中氢前的金属,酸除了浓硫酸和硝酸外.
解答:解:(1)由于滤液A蒸发至干得到的是硫酸锌,而滤液B和滤液A含有相同的溶质,说明它们的溶质是硫酸锌;而固体B能被磁铁吸引,说明固体B应是金属铁,故答案为:硫酸锌,Fe
(2)由于步骤①是向废液中加入过量的金属锌,得到的是硫酸锌溶液和固体铁、铜、锌,说明废液中含有硫酸铜和硫酸亚铁(或硫酸铁),故答案为:Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe)
(3)步骤①中加入了过量的金属锌,就是为了把废液中的铜离子和亚铁离子(或铁离子)全部置换出来,故答案为:确保废液中的铁离子和铜离子完全反应
(4)想通过蒸发溶剂的方法从溶液中得到晶体,应在蒸发皿中进行,而且为了避免液体受热不均,引起液体飞溅,应用玻璃棒不断的搅拌;等到蒸发皿中出现大量固体时就停止加热,靠余温把剩余的水分蒸干.
故答案为:蒸发皿;使溶液均匀受热,防止液滴飞溅;蒸发皿中出现较多固体
(2)由于步骤①是向废液中加入过量的金属锌,得到的是硫酸锌溶液和固体铁、铜、锌,说明废液中含有硫酸铜和硫酸亚铁(或硫酸铁),故答案为:Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe)
(3)步骤①中加入了过量的金属锌,就是为了把废液中的铜离子和亚铁离子(或铁离子)全部置换出来,故答案为:确保废液中的铁离子和铜离子完全反应
(4)想通过蒸发溶剂的方法从溶液中得到晶体,应在蒸发皿中进行,而且为了避免液体受热不均,引起液体飞溅,应用玻璃棒不断的搅拌;等到蒸发皿中出现大量固体时就停止加热,靠余温把剩余的水分蒸干.
故答案为:蒸发皿;使溶液均匀受热,防止液滴飞溅;蒸发皿中出现较多固体
点评:本题难度不是很大,主要考查了对金属活动性顺序的应用,根据金属活动性顺序来判断反应的发生,从而推断物质的组成,培养学生灵活运用知识的能力.

练习册系列答案
相关题目