题目内容
取2.5 g含有杂质的碳酸钙样品,跟盐酸反应(所含杂质不跟盐酸反应),反应完全时,共用去质量分数为10%的盐酸14.6 g,计算该样品中碳酸钙的质量分数.
解析:
|
解:14.6 g盐酸中HCl的质量:14.6 g×10%=1.46 g 设样品所含碳酸钙的质量为x, CaCO3+2HCl 100 2×36.5 x 1.46 g x= 则该样品中碳酸钙的质量分数为: |

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案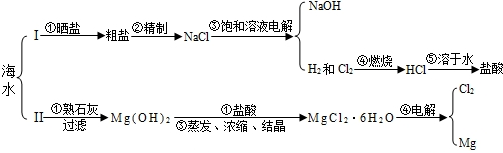
请根据下列部分酸碱盐溶解性表回答下列问题:
| OH- | Cl- | SO42- | CO32- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
①过滤 ②溶解 ③蒸发
(2)过滤后所得滤液仍然浑浊,可能的原因是
①滤纸破损 ②过滤时漏斗里的液面高于滤纸的边缘 ③漏斗颈下端管口没有紧靠烧杯内壁.
(3)如果海水中含有的可溶性杂质主要为CaCl2、MgSO4,则方案Ⅰ中步骤②“精制”时:欲沉淀杂质CaCl2,一般加入稍过量的碳酸钠溶液,此反应方程式为
如果井水或溪水中含有Ca2+、Mg2+,这种水称作
(4)方案Ⅱ中步骤①生成Mg(OH)2的反应方程式为
如果熟石灰是用海边的贝壳(主要成分为CaCO3)生成的,则生产熟石灰的反应方程式为:
(5)方案Ⅱ中除步骤①中用过滤外,还要用到“过滤”步骤的是
(6)下图是某种加钙食盐包装袋标签上的部分说明文字(Ca-40,C-12,O-16):
| 配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500g 成分表:氯化钠≥88% 钙(以Ca计)(0.5-1.3)% 碘(以I计)(20-50)mg/kg |
(7)某化工厂为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水制成252g溶液,再加入53g溶质质量分数为10%的碳酸钠溶液,恰好完全反应.求:
①样品中杂质CaCl2的质量;
②样品中氯化钠的质量;
③样品中氯化钠的质量分数;
④反应后所得溶液中溶质的质量分数.
| |||||||||||||||||||||||||||||||||||||
为测定某大理石样品中碳酸钙(杂质不溶于水也不参与反应)的质量分数,某小![]() 组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5 g样品研碎放入烧杯中,每次加入20.8 g稀盐酸后并用电子天平称量,记录实验数据如下。请回答:
组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5 g样品研碎放入烧杯中,每次加入20.8 g稀盐酸后并用电子天平称量,记录实验数据如下。请回答:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
| 烧杯及所称物质总质量/g | 72.2 | 91.9 | 111.6 | 131.3 | 152.1 |
⑴第2次加入20.8克稀盐酸的反应过程中生成CO2的质量为 g,整个反应过程中共生成CO2的质量为 g
⑵求实验中每20.8克稀盐酸中含有溶质的质量;
⑶恰好完全反应时烧杯内溶液的溶质质量分数。



