题目内容
某石灰石样品(主要成分是碳酸钙)中碳元素的质量分数为9%,则该样品中的纯度为( )
| A、30% | B、45% | C、75% | D、80% |
分析:先计算出纯净的碳酸钙中碳元素的质量分数,再根据纯度=
×100%,进行解答.
| 含杂质物质中某元素的质量分数 |
| 纯净物质中某元素的质量分数 |
解答:解:碳酸钙中碳元素的质量分数=
×100%=12%,石灰石样品中含碳元素9%,
根据纯度=
×100%,
可知样品中含碳酸钙的质量分数=
×100%=75%;
故选C.
| 12 |
| 100 |
根据纯度=
| 含杂质物质中某元素的质量分数 |
| 纯净物质中某元素的质量分数 |
可知样品中含碳酸钙的质量分数=
| 0.9 |
| 0.12 |
故选C.
点评:本题考查学生对物质纯度的计算方法的理解与掌握,并能在解题中灵活应用.

练习册系列答案
相关题目
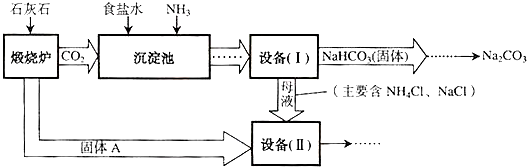
工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:

(1)NaHCO3俗称______,该物质受热分解成碳酸钠和两种氧化物,写出反应的化学方程式______,还可以用来治疗胃酸过多,反应方程式是______.
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是______.
(3)写出设备( II)中发生的复分解反应的方程式______.
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有______(填写化学式).
(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
| 反应时间 | T0 | T1 | T2 | T3 | T4 | T5 | T6 |
| 反应后固体的质量 | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
①石灰石完全反应后生成二氧化碳的质量为______克.
②该石灰石样品中碳酸钙的质量分数,写出计算过程.




 和
和 对实验的影响.
对实验的影响.