题目内容
 某同学用图装置测定空气中氧气的体积分数.请你填写有关空格
某同学用图装置测定空气中氧气的体积分数.请你填写有关空格
(1)红磷在瓶内燃烧的现象为______
(2)该实验可以空气中氧气的体积约占 ,但是在实验后发现测定出的空气中氧气的体积分数低于
,但是在实验后发现测定出的空气中氧气的体积分数低于 ,可能是由哪些原因起的?______(写一条原因).
,可能是由哪些原因起的?______(写一条原因).
(3)若将红磷换成碳粉,该实验能否获得成功?______(填能或否)理由是______.
(2)装置气密性不好;红磷不足量;没有冷却至室温就读数,都可以导致水量的进入少于集气瓶体积的
 ,从而导致测定出的空气中氧气的体积分数低于
,从而导致测定出的空气中氧气的体积分数低于 ;
;(3)木炭燃烧生成二氧化碳气体,占据了消耗掉的氧气的空间,因此不可以采用碳代替红磷.
故答案为:(1)发黄光、放出热量、冒出大量的白烟.(2)装置气密性不好;(3)否;木炭燃烧会生成二氧化碳气体,二氧化碳占据了消耗掉的氧气空间,所以实验会失败;
分析:本题是测定空气中氧气的含量,我们常用燃烧红磷或白磷的方法,因为磷燃烧生成白色固体五氧化二磷,几乎不占空间,使得内外产生气压差,从而得到正确的结论.因此在选择可燃物时,必须考虑到:燃烧的条件;生成物的状态;不与空气中其他物质发生反应.保证本实验成功的关键是:①装置气密性好;②红磷要足量;③要冷却至室温再读数.
点评:本考点考查了空气中氧气的含量的探究,并且注重了实验方案的评价,对实验方案进行评价是近几年中考的一个重点.评价包括对实验方案的评价、实验过程的评价、实验结论的评价等,要认真把握.

 阅读快车系列答案
阅读快车系列答案探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl; ②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
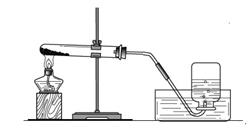
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。

实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气 。
(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
|
|
实验方案 |
实验现象 |
实验结论 |
|
方 案 一 |
将Fe丝浸入CuSO4溶液中 |
Fe丝表面有红色物质析出 |
金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
|
方 案 二 |
将Mg和Cu分别在空气中灼烧 |
发现镁能剧烈燃烧,而另一种不能 |
金属活动性:Mg_ _Cu(填“>”或“<”) |
|
方 案 三 |
分别将Mg和Fe放入_________中,观察现象 |
观察到_ (填元素符号)产生气泡的速度较慢 |
金属活动性顺序:Mg>Fe |
 (2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
(2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
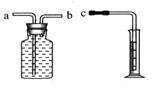
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl;②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。

实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气 。
(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
|
| 实验方案 | 实验现象 | 实验结论 |
| 方 案 一 | 将Fe丝浸入CuSO4溶液中 | Fe丝表面有红色物质析出 | 金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
| 方 案 二 | 将Mg和Cu分别在空气中灼烧 | 发现镁能剧烈燃烧,而另一种不能 | 金属活动性:Mg_ _Cu(填“>”或“<”) |
| 方 案 三 | 分别将Mg和Fe放入_________中,观察现象 | 观察到_ (填元素符号)产生气泡的速度较慢 | 金属活动性顺序:Mg>Fe |
 (2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
(2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl; ②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。
实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气
 。
。(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
| | 实验方案 | 实验现象 | 实验结论 |
| 方 案 一 | 将Fe丝浸入CuSO4溶液中 | Fe丝表面有红色物质析出 | 金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
| 方 案 二 | 将Mg和Cu分别在空气中灼烧 | 发现镁能剧烈燃烧,而另一种不能 | 金属活动性:Mg_ _Cu(填“>”或“<”) |
| 方 案 三 | 分别将Mg和Fe放入_________中,观察现象 | 观察到_ (填元素符号)产生气泡的速度较慢 | 金属活动性顺序:Mg>Fe |
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl; ②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。
实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气 。
(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
| | 实验方案 | 实验现象 | 实验结论 |
| 方 案 一 | 将Fe丝浸入CuSO4溶液中 | Fe丝表面有红色物质析出 | 金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
| 方 案 二 | 将Mg和Cu分别在空气中灼烧 | 发现镁能剧烈燃烧,而另一种不能 | 金属活动性:Mg_ _Cu(填“>”或“<”) |
| 方 案 三 | 分别将Mg和Fe放入_________中,观察现象 | 观察到_ (填元素符号)产生气泡的速度较慢 | 金属活动性顺序:Mg>Fe |
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
