题目内容
8.下图所表示的各实验操作,哪一项可以将食盐水中的食盐分离出来( )| A. |  | B. |  | C. |  | D. |  |
分析 将食盐水中的食盐分离出来,可采用蒸发结晶的方法,进行分析判断.
解答 解:A、向食盐水中加水,不能将食盐水中的食盐分离出来,故选项错误.
B、过滤,只能除去食盐水中的不溶性杂质,不能将食盐水中的食盐分离出来,故选项错误.
C、蒸发,能除去食盐水中的水分,能将食盐水中的食盐分离出来,故选项正确.
D、向食盐水中加入食盐水,不能将食盐水中的食盐分离出来,故选项错误.
故选:C.
点评 本题难度不大,了解常见的物质分离的方法(过滤、蒸发等)与原理并能灵活运用是正确解答本题的关键.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
19.工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析.
【资料1】草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$CO2↑+CO↑+4H2O
【问题讨论】用如图所示装置进行实验:
(1)实验前应先检查装置的气密性.
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是检验二氧化碳是否被A装置完全吸收.
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后把反应生成的二氧化碳全部排入E装置中.
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数
(5)称取铁红样品10.0g用上述装置进行实验,测定铁红中铁的质量分数.
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是7.0<m<7.78.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76.0%.(计算结果精确到0.1%)
【实验评价】
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小(填“偏小”、“不变”或“偏大”).
【资料1】草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$CO2↑+CO↑+4H2O
【问题讨论】用如图所示装置进行实验:

(1)实验前应先检查装置的气密性.
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是检验二氧化碳是否被A装置完全吸收.
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后把反应生成的二氧化碳全部排入E装置中.
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是7.0<m<7.78.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76.0%.(计算结果精确到0.1%)
【实验评价】
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小(填“偏小”、“不变”或“偏大”).
16.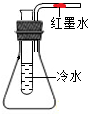 如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )
如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )
 如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )
如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )| A. | 氢氧化钠固体 | B. | 生石灰 | C. | 浓硫酸 | D. | 蔗糖 |
13.下列有关盐酸叙述错误的是( )
| A. | 打开盛有浓盐酸的试剂瓶瓶塞,在瓶口出现白雾 | |
| B. | 稀盐酸可用于除铁锈 | |
| C. | 浓盐酸可用来干燥氧气 | |
| D. | 在稀盐酸滴加氢氧化钡溶液,出现白色沉淀 |
20.根据你的生活经验和所学的化学知识,判断下列做法正确的是( )
| A. | 用钢丝球洗刷铝锅脏物 | |
| B. | 用洗洁精洗去餐具上的油污,是因为它具有乳化作用 | |
| C. | 铵态氮肥与熟石灰混合使用可以明显提高肥效 | |
| D. | 为减少“白色污染”,应将废弃塑料制品随地焚烧 |
18.有关化学之最说法正确的是( )
| A. | 结构最简单的原子是氢原子 | |
| B. | 最早通过实验得出空气由N2和O2组成的结论的科学家是法国化学家汤姆生 | |
| C. | 导电性最好的金属是铜 | |
| D. | 自然界的矿物质中最硬的物质是石墨 |
 如图是某同学正在绘制的在实验室用混合物制取氧气的装置图
如图是某同学正在绘制的在实验室用混合物制取氧气的装置图