题目内容
16. 我们通过学习探究,知道物质构成的奥秘.
我们通过学习探究,知道物质构成的奥秘.(1)请在方框中填写粒子名称,表示各种粒子是怎样构成物质的.
(2)选择图中适应粒子填空:
①化学变化中最小粒子是:原子.
②同一原子中数目相等的是:质子、核外电子;
③不显电性的是:分子、原子、中子;
④决定相对原子质量大小的是:质子和中子.
分析 (1)根据已有的知识进行分析,构成物质的基本微粒是微粒是分子、原子和离子,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,据此解答;
(2)根据分子是保持物质化学性质的最小微粒;原子是化学变化中最小微粒,原子是由原子核和核外电子组成,原子核由质子和中子组成(质子带正电,中子不带电).原子核带正电,又电子(电子质量很小)带负电,两者的带电量相同,一正一负,所以整个原子显示的是电中性;在原子中,原子序数=质子数=核电荷数=核外电子数;进行解答;
解答 解:(1)构成物质的基本微粒是微粒是分子、原子和离子,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故填:
(2)①在化学反应中分子分成原子,原子再重新组合成新的分子,所以在化学反应中分子可以再分,原子不能再分,即原子是化学变化中的最小粒子.
②在同一原子中数目相等的是质子、核外电子;
③不显电性的是分子、原子、中子;
④原子的质量集中在原子核上,而原子核是由质子和中子构成的,故决定相对原子质量大小的是由质子和中子决定的;
故答案为:(1)
(2)①原子;②质子、核外电子;③分子、原子、中子;④质子和中子;
点评 本题难度不大,考查学生对物质的构成、原子的构成、原子核的构成、各种微粒的电性,决定元素相对原子质量大小的因素的理解与掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.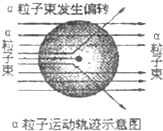 1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验.在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:
1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验.在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:
(1)大多数α粒子能穿透金箔而不改变原来的运动方向;
(2)一小部分α粒子改变了原来的运动方向;
(3)有极少部分α粒子被弹了回来.
下列对原子结构的认识错误的是( )
 1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验.在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:
1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验.在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:(1)大多数α粒子能穿透金箔而不改变原来的运动方向;
(2)一小部分α粒子改变了原来的运动方向;
(3)有极少部分α粒子被弹了回来.
下列对原子结构的认识错误的是( )
| A. | 原子内部有很大的空间 | B. | 原子核带正电 | ||
| C. | 原子核体积很大 | D. | 原子是实心的球体 |
7.下列实例不属于中和反应的是( )
| A. | 金属表面锈蚀后,可用稀盐酸进行清洗 | |
| B. | 胃酸分泌过多的病人服用含有氢氧化铝的药物 | |
| C. | 蚊虫叮咬时会向人体释放一种酸,如果涂含稀氨水的药水就可减轻痛痒 | |
| D. | 土壤酸化后加入熟石灰改良 |
4.有人专程到首饰店购买铂金项链,当时,货架上有标着“Pd-990”的钯金项链和标着“Pt-950”的铂金项链,他却要了前者.此消费者最有可能对下面哪个科学概念或物质的性质缺乏认识( )
| A. | 铂金和钯金的颜色 | B. | 金属原子结构 | ||
| C. | 相对原子质量 | D. | 元素符号 |
11.下列实验操作中错误的是( )
| A. | 用规格为10 mL 的量筒量取6 mL 的液体 | |
| B. | 配制10%的氯化钠溶液的主要步骤是:计算、称量、溶解 | |
| C. | 过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 为以免浪费和 污染,将用剩的药品放回原试剂瓶 |
8. 在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.
在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.
资料一:已知碳酸钙与盐酸的复分解反应可自发进行.在常温下,测得浓度均为a%的下列四种溶液的pH大小情况;
资料二:常见干燥剂有①五氧化二磷②无水氯化钙③碱石灰④生石灰.
请你参与探究并完成相关问题.
(1)表中pH大小情况揭示出复分解反应的一条规律:较强酸发生类似反应可以生成较弱酸.下列反应均能发生,但不符合上述规律的是C(填字母)
A.HCl+NaHCO3=NaCl+H2O+CO2↑
B.2HCl+CaS=CaCl2+H2S↑
C.H2S+CuSO4=H2SO4+CuS↓
(2)根据以上信息,为了得到干燥、纯净的二氧化碳,设计了如图装置,请你分析:
①已知B装置的作用是除去HCl气体.A装置中可以放硫酸铜溶液,是为了检验并除去其中的H2S,从而确定大理石中是否含有硫化钙.
②在装置中,C仪器中装着的物质不可能是③④(选填序号“①五氧化二磷”、“②无水氯化钙”、“③碱石灰”或“④生石灰”).
 在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.
在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.资料一:已知碳酸钙与盐酸的复分解反应可自发进行.在常温下,测得浓度均为a%的下列四种溶液的pH大小情况;
资料二:常见干燥剂有①五氧化二磷②无水氯化钙③碱石灰④生石灰.
请你参与探究并完成相关问题.
(1)表中pH大小情况揭示出复分解反应的一条规律:较强酸发生类似反应可以生成较弱酸.下列反应均能发生,但不符合上述规律的是C(填字母)
| 溶质 | H2SO4 | HCl | H2S | H2CO3 |
| pH | 小→大 | |||
B.2HCl+CaS=CaCl2+H2S↑
C.H2S+CuSO4=H2SO4+CuS↓
(2)根据以上信息,为了得到干燥、纯净的二氧化碳,设计了如图装置,请你分析:
①已知B装置的作用是除去HCl气体.A装置中可以放硫酸铜溶液,是为了检验并除去其中的H2S,从而确定大理石中是否含有硫化钙.
②在装置中,C仪器中装着的物质不可能是③④(选填序号“①五氧化二磷”、“②无水氯化钙”、“③碱石灰”或“④生石灰”).