题目内容
小明同学将16g高锰酸钾放在试管里加热制取氧气,反应一段时间后,称量试管内剩余固体的质量为14.4g.
求:
(1)生成氧气的质量为
(2)生成二氧化锰的质量为多少克?
求:
(1)生成氧气的质量为
1.6
1.6
g.(2)生成二氧化锰的质量为多少克?
分析:(1)根据质量守恒定律利用反应前后固体的质量之差即可求出氧气的质量;
(2)利用氧气的质量依据方程式可以求出生成的二氧化锰,据此解答即可.
(2)利用氧气的质量依据方程式可以求出生成的二氧化锰,据此解答即可.
解答:解:(1)根据质量守恒定律,当固体质量变为14.4g时,生成氧气的质量为16g-14.4g=1.6g;故填:1.6;
(2)设生成MnO2的质量为x.
2KMnO4
K2MnO4+MnO2+O2↑
87 32
x 1.6g
=
x=4.35g
答:生成二氧化锰的质量为4.35g.
(2)设生成MnO2的质量为x.
2KMnO4
| ||
87 32
x 1.6g
| 87 |
| x |
| 32 |
| 1.6g |
x=4.35g
答:生成二氧化锰的质量为4.35g.
点评:此题考查的根据关化学方程式的计算,通过认真分析题干,直接得到氧气的质量,是解题的关键.

练习册系列答案
相关题目
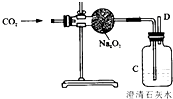 “嫦娥三号”飞船的成功发射是我国航天事业的又一里程碑.金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气和碳酸钠;为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.
“嫦娥三号”飞船的成功发射是我国航天事业的又一里程碑.金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气和碳酸钠;为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.