题目内容
有 、
、 溶液、NaOH溶液,稀
溶液、NaOH溶液,稀 等四种物质,从上述物质中选择适当的物质,按下列要求写出化学方程式,并注明基本反应类型。
等四种物质,从上述物质中选择适当的物质,按下列要求写出化学方程式,并注明基本反应类型。
(1)有水生成的反应为 , 。
(2)有蓝色沉淀生成的反应为 , 。
 、
、 溶液、NaOH溶液,稀
溶液、NaOH溶液,稀 等四种物质,从上述物质中选择适当的物质,按下列要求写出化学方程式,并注明基本反应类型。
等四种物质,从上述物质中选择适当的物质,按下列要求写出化学方程式,并注明基本反应类型。(1)有水生成的反应为 , 。
(2)有蓝色沉淀生成的反应为 , 。
(1)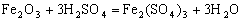 ; 复分解反应
; 复分解反应
(2)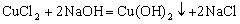 ; 复分解反应
; 复分解反应
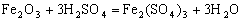 ; 复分解反应
; 复分解反应(2)
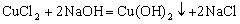 ; 复分解反应
; 复分解反应 
练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目



 (2011?南阳二模)实验室有一瓶保管不当的试剂(如图),其残缺的标签中剩下“Na”和“10%”的字样.
(2011?南阳二模)实验室有一瓶保管不当的试剂(如图),其残缺的标签中剩下“Na”和“10%”的字样.
 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.