题目内容
甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下:

计算:
(1)金属混合物中铁的质量分数;
(2)该稀硫酸中溶质的质量分数。
[问题拓展]若将甲、乙、丙三位同学所取的物质放人到一只大烧杯中,反应完全后过滤得到干燥固体的质量___________g。(不要求写计算过程)
(1)金属混合物中铁的质量分数;
(2)该稀硫酸中溶质的质量分数。
[问题拓展]若将甲、乙、丙三位同学所取的物质放人到一只大烧杯中,反应完全后过滤得到干燥固体的质量___________g。(不要求写计算过程)
(1)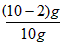 ×100%= 80%:
×100%= 80%:
(2)设H2SO4的质量为x。
Fe+ H2SO4 ==FeSO4+ H2 ↑;
56 98
8g x
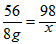 ,x=14g。
,x=14g。
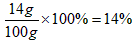
[问题拓展] 40g金属混合物中含铜8g,含铁32g, 320g稀H2SO4中含H2SO4质量为320g×14% =44.8g。
设与44. 8g H2SO4反应的铁的质量为y。
Fe+ H2SO4 == FeSO4+ H2 ↑
56 98
y 44. 8g
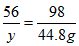 ,y=25. 6g。
,y=25. 6g。
剩下固体的质量为32g - 25.6g +8g= 14.4g。
[答案](1)80%;(2)14%.(3)14.4
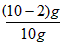 ×100%= 80%:
×100%= 80%:(2)设H2SO4的质量为x。
Fe+ H2SO4 ==FeSO4+ H2 ↑;
56 98
8g x
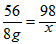 ,x=14g。
,x=14g。 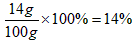
[问题拓展] 40g金属混合物中含铜8g,含铁32g, 320g稀H2SO4中含H2SO4质量为320g×14% =44.8g。
设与44. 8g H2SO4反应的铁的质量为y。
Fe+ H2SO4 == FeSO4+ H2 ↑
56 98
y 44. 8g
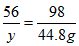 ,y=25. 6g。
,y=25. 6g。剩下固体的质量为32g - 25.6g +8g= 14.4g。
[答案](1)80%;(2)14%.(3)14.4

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目