题目内容
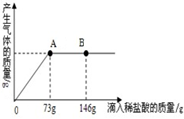 在一烧杯中盛有32.2gCaCO3和CaCl2的粉末状混合物,向其中加入200g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,产生气体的质量与所滴入稀盐酸的质量关系曲线如图所示.请根据题意回答下列问题:
在一烧杯中盛有32.2gCaCO3和CaCl2的粉末状混合物,向其中加入200g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,产生气体的质量与所滴入稀盐酸的质量关系曲线如图所示.请根据题意回答下列问题:(1)在滴入稀盐酸的过程中,观察到的明显现象是:
①
产生气泡
产生气泡
.②
溶液中的不溶物逐渐减少至消失
溶液中的不溶物逐渐减少至消失
.(2)当滴入10%的稀盐酸至图中B点时,烧杯中溶液里含有的溶质是(写化学式)
CaCl2、HCl
CaCl2、HCl
.(3)写出坐标中曲线上A点的含义
碳酸钙与盐酸恰好完全反应
碳酸钙与盐酸恰好完全反应
.(4)当滴入10%的稀盐酸73g时(即A点),试通过计算,求此时烧杯中所得不饱和溶液中溶质的质量分数.(结果精确到0.1%)
分析:(1)根据盐酸与碳酸钙反应分析
(2)根据图象分析反应过程,从而确定溶液中的溶质
(3)根据图象中转折点的含义分析
(4)根据氯化氢的质量求出碳酸钙、生成的氯化钙和二氧化碳的质量,从而求出溶质质量分数.
(2)根据图象分析反应过程,从而确定溶液中的溶质
(3)根据图象中转折点的含义分析
(4)根据氯化氢的质量求出碳酸钙、生成的氯化钙和二氧化碳的质量,从而求出溶质质量分数.
解答:解:(1)碳酸钙与盐酸反应产生二氧化碳,故滴入盐酸后看到的现象产生气泡,溶液中的不溶物逐渐减少至消失
(2)当滴入10%的稀盐酸至图中B点时,盐酸过量,溶液中的溶质是氯化钙和氯化氢,化学式为CaCl2、HCl
(3)A点表示盐酸和碳酸钙恰好完全反应
(4)设A点时,盐酸与碳酸钙反应生成的氯化钙的质量为x,碳酸钙的质量为y,生成二氧化碳的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
y 73g×10% x z
=
=
=
y=10g x=11.1g z=4.4g
此时溶液中溶质氯化钙的质量=11.1g+32.2g-10g=33.3g
溶液质量=32.2g+200g+73-4.4g=300.8g
溶液中溶质质量分数=
×100%=11.1%
答:溶液中溶质质量分数为11.1%
故答案为:(1)①产生气泡.
②溶液中的不溶物逐渐减少至消失.
(2)CaCl2、HCl.
(3)碳酸钙与盐酸恰好完全反应.
(2)当滴入10%的稀盐酸至图中B点时,盐酸过量,溶液中的溶质是氯化钙和氯化氢,化学式为CaCl2、HCl
(3)A点表示盐酸和碳酸钙恰好完全反应
(4)设A点时,盐酸与碳酸钙反应生成的氯化钙的质量为x,碳酸钙的质量为y,生成二氧化碳的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
y 73g×10% x z
| 100 |
| y |
| 73 |
| 73g×10% |
| 111 |
| x |
| 73 |
| 73×10% |
| 44 |
| z |
y=10g x=11.1g z=4.4g
此时溶液中溶质氯化钙的质量=11.1g+32.2g-10g=33.3g
溶液质量=32.2g+200g+73-4.4g=300.8g
溶液中溶质质量分数=
| 33.3g |
| 300.8g |
答:溶液中溶质质量分数为11.1%
故答案为:(1)①产生气泡.
②溶液中的不溶物逐渐减少至消失.
(2)CaCl2、HCl.
(3)碳酸钙与盐酸恰好完全反应.
点评:本题考查根据化学方程式的计算,考查学生分析图象与计算能力.

练习册系列答案
相关题目
在天平两端的烧杯中盛有等质量,等溶质质量分数的盐酸溶液,天平平衡.向一只烧杯中加入一定质量的镁,另一只烧杯中加入一定质量的铝,充分反应后,天平仍然平衡.则加入Mg和Al的质量比可能是( )
| A、11:12 | B、32:33 | C、33:32 | D、1:1 |
