题目内容
16.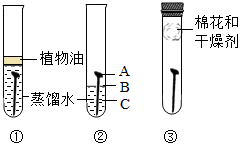 某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:
某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:(1)下列有关说法正确的是BCD
A.一周后可观察到:试管①和③中的铁钉无明显变化;试管②中的铁钉明显生锈,且C处生锈最严重;
B.试管①中加入的蒸馏水应是新制的蒸馏水,其目的是排尽其中的氧气
C.试管③中可选用氢氧化钠固体做干燥剂,以除去空气中的水蒸气
D.由此实验可以推断,可以通过在铁制品表面涂油、刷漆、镀金属保护膜、烤蓝、保持铁制品表面干燥等措施防止钢铁生锈
(2)若要除去实验中生锈的铁钉表面的锈,试写出除去铁锈的化学方程式Fe2O3+6HCl=2FeCl3+3H2O.
分析 (1)A.根据铁生锈的条件进行分析判断;B.根据试管①中蒸馏水的作用分析判断;C.根据氢氧化钠固体的物理性质进行分析判断;D.根据探究铁生锈条件的实验原理进行分析判断;
(2)根据稀盐酸的用途书写化学方程式.
解答 解:(1)A.由实验图可知试管①中铁钉缺少氧气,所以无明显现象;试管③中的铁钉缺少水份,所以无明显现象;只有试管②中的铁钉既与空气接触又与水份接触所以能生锈,而且B处铁钉与水份接触较充分所以生锈最严重,故A不正确;
B.试管①中蒸馏水的作用是隔绝空气,所以要用新制的蒸馏水,因为水在加热沸腾时水中溶解的氧气已排出,故B正确;
C.氢氧化钠固体易潮解能吸收空气中的水蒸气,成以可用于除去空气中的水蒸气,故C正确;
D.该实验可得出的结论是铁生锈需要与空气(氧气)和水份同时接触才能生锈,由此可以推断,保持铁制品表面干燥或隔绝空气和水份都可以防止钢铁生锈,故D正确;
(2)稀盐酸可以和氧化铁反应生成氯化铁和水,发生反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
故答案为:(1)BCD;(2)Fe2O3+6HCl=2FeCl3+3H2O;
点评 此题考查学生对钢铁锈蚀条件探究实验的掌握情况,掌握铁锈蚀的条件(铁与氧气、水同时接触)并能灵活运用是正确解答本题的关键.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
18.如图是某反应的微观示意图,有关说法错误的是( )
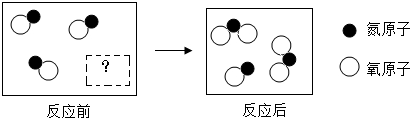

| A. | 反应前虚框中的微粒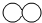 为 为 | |
| B. | 该反应过程中氮元素的化合价发生了改变 | |
| C. | 反应前后分子和原子的种类不变 | |
| D. | 该反应过程中参加反应的和生成的各分子个数比可以为2:1:2 |
4.四氧化三铁可用于医疗器械、电子等工业.某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验.
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表所示.
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液.
(3)制备Fe3O4的实验流程如下:

【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4或2NaOH+FeSO4═Fe(OH)2↓+Na2SO4(写出其中一个).
(2)操作a的名称为过滤.该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗等.玻璃棒在此操作中的主要作用是引流.
(3)溶液1所含溶质有NaOH、Na2SO4、MgSO4(至少写两种成分的化学式);溶液3所含溶质的主要成分为硫酸亚铁(写名称).
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表所示.
| Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀的pH | 5.7 | 7.6 | 10.4 |
| 沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(3)制备Fe3O4的实验流程如下:

【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4或2NaOH+FeSO4═Fe(OH)2↓+Na2SO4(写出其中一个).
(2)操作a的名称为过滤.该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗等.玻璃棒在此操作中的主要作用是引流.
(3)溶液1所含溶质有NaOH、Na2SO4、MgSO4(至少写两种成分的化学式);溶液3所含溶质的主要成分为硫酸亚铁(写名称).
11.具有下列pH的溶液中,酸性最强的是( )
| A. | pH=7 | B. | pH=1 | C. | pH=0 | D. | pH=14 |
 如图是小张同学测定空气中氧气体积分数的实验装置,根据题意回答以下问题.
如图是小张同学测定空气中氧气体积分数的实验装置,根据题意回答以下问题.