题目内容
【题目】如图是元素周期表的一部分,试回答下列问题。

(1)写出①所示原子结构示意图_________;第14号元素属于______(填“金属”或“非金属”)元素;
(2)氯离子的最外层电子数是___________;
(3)②所示元素与氯元素形成化合物的化学式是____________;
(4)地壳中含量最多的金属元素位于元素周期表的第________周期;
(5)每一周期的元素从左到右排列所遵循的一条规律是_______________________。
【答案】 非金属 8 NaCl 三 原子序数逐渐增大(或质子数逐渐增大等,合理即可)。
非金属 8 NaCl 三 原子序数逐渐增大(或质子数逐渐增大等,合理即可)。
【解析】
(1)①是6号碳元素,碳原子结构示意图为: ;第14号元素是硅元素,属于非金属元素;故填:
;第14号元素是硅元素,属于非金属元素;故填: ;非金属;
;非金属;
(2)氯原子最外层电子数为7,得到一个电子形成氯离子,氯离子的最外层电子数是8。故填:8;
(3)②所示元素是钠元素,钠元素与氯元素形成化合物是氯化钠,氯化钠中钠元素显+1价,氯元素显-1价,氯化钠的化学式是NaCl。故填:NaCl;
(5)地壳中含量最多的金属元素是铝元素,铝原子核外电子层数是3,位于周期表的第三周期。故填:三;
(5)每一周期的元素从左到右排列所遵循的一条规律是:原子序数逐渐增大或质子数逐渐增大等。故填:原子序数逐渐增大(或质子数逐渐增大等,合理即可)。

【题目】实验小组同学在一定温度下进行硝酸钾的固体的溶解实验。
(定性研究)同学们进行如下实验,发现1号试管中硝酸钾全部溶解,2号试管中固体没有完全溶解。由此获得的实验结论是____________。要使2号试管中的固体全部溶解,可采取的方法有___________、_____________。
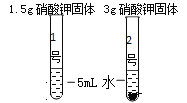
(定量研究)实验小组同学在一定温度下进行硝酸钾的固体溶液实验。实验数据如下。请根据数据进行分析。
实验序号 | 实验1 | 实验2 | 实验3 | 实验4 |
水的质量(g) | 100 | 100 | 100 | 100 |
加入硝酸钾的质量(g) | 80 | 100 | 120 | 140 |
溶液质量(g) | 180 | 200 | 210 | M |
(1)请计算实验2中硝酸钾的溶质质量分数是_____________。
(2)现将实验2中的溶液稀释成20%的硝酸钾溶液,需要加水的质量为___________g。
(3)请判断实验2中硝酸钾溶液是________溶液。(选填“饱和”或“不饱和”)。
(4)实验4中M的数值是_______。