题目内容
4.某实验小组利用图1所示的仪器进行“配制质量分数一定的氯化钠溶液”的实验: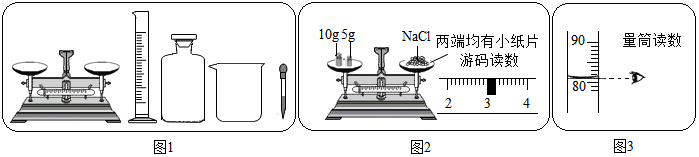
(1)图1中仪器a的名称是烧杯;
(2)完成此实验正确的操作顺序是④③①②(填序号);
①溶解 ②把配好的溶液装入试剂瓶 ③称量 ④计算
(3)按实验要求,图1中还缺少的玻璃仪器是玻璃棒(填名称);
(4)小倩按图2的操作称取氯化钠,小民发现小倩的操作有错误.你认为小倩操作中的错误是药品和砝码的位置放反了;她称取的氯化钠实际质量为12g.
(5)如果按小倩操作进行实验,则配制的氯化钠溶液溶质质量分数偏小(填“偏大”或“偏小”).
分析 (1)根据实验室常用仪器的名称与用途填空;
(2)依据配制溶液的步骤:计算、称量、溶解、装瓶,对照选项进行解答;
(3)先由图示判断该步是什么操作,再由操作判断所用仪器,最后确定所缺仪器;
(4)使用托盘天平称量物品时,要“左物右码”,正确称量时:“物品质量=砝码质量+游码质量”得出物码放反的计算公式,进而得出实际质量;
(5)由图示中所示数据计算每小格所表示的质量,进而得出正确结果,由溶质质量分数的计算公式求出所需结果.
解答 解:(1)图1中仪器a的名称是烧杯.故填:烧杯;
(2)配制溶液的步骤为:计算、称量、溶解、装瓶存放.故填:④③①②;
(3)该图表示配制溶液全过程需用的所用仪器,称量氯化钠固体需要托盘天平、量取水的体积需要量筒,溶解时还会用到烧杯和玻璃棒,故填:玻璃棒;
(4)由图示可以看出托盘天平的使用错误,物码放反了,所以,药品实际质量=砝码质量-游码质量=15g-3g=12g.故填:药品和砝码的位置放反了;12;
(5)由图示中所示数据可得,每小格所表示的质量为1mL,水的体积为82mL,再由水的密度1g/mL,由公式m=ρV得出水的质量为:82mL×1g/mL=82g,由托盘天平中砝码与游码的质量可知,该实验欲称药品质量为:10g+5g-3g=12g,溶液质量为:82g+12g=94g,由溶质质量分数的计算公式得溶质质量分数为:$\frac{12g}{94g}$×100%≈12.8%<15%,所以实际配制溶液的质量分数偏小.故填:偏小.
点评 该题以溶液配制为载体,考查了仪器的名称与用途、操作的步骤、错误或不规范操作引起的溶质质量变化、量筒的读数、溶质质量分数的计算等问题,解答时要看清图示,结合具体知识点进行解答.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
3.下列标志中,与燃烧无关的是( )
| A. |  | B. |  | C. |  | D. |  |
4.根据下表回答问题.
(1)40℃时,氯化钠固体的溶解度是36.6g/100g水.
(2)60℃时在100g水中加入100g硝酸钾固体,充分溶解后所形成的溶液是不饱和溶液(“饱和”或“不饱和”).
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g/100g水) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(2)60℃时在100g水中加入100g硝酸钾固体,充分溶解后所形成的溶液是不饱和溶液(“饱和”或“不饱和”).
1. NH4Cl和NaCl的溶解度随温度变化如图所示,下列说法正确的是( )
NH4Cl和NaCl的溶解度随温度变化如图所示,下列说法正确的是( )
 NH4Cl和NaCl的溶解度随温度变化如图所示,下列说法正确的是( )
NH4Cl和NaCl的溶解度随温度变化如图所示,下列说法正确的是( )| A. | NH4Cl的溶解度一定大于NaCl | |
| B. | 将NaCl溶液降温一定会有NaCl固体析出 | |
| C. | 50℃时饱和溶液的溶质质量分数为50% | |
| D. | 将t℃时,NH4Cl和NaCl的饱和溶液加热至50℃,两溶液的溶质质量分数相等 |
16.将一定质量的a、b、c、d四种物质放入一容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表,下列说法中错误的是( )
| 物质 | a | b | c | d |
| 反应前质量/g | 6.40 | 3.20 | 4.00 | 0.50 |
| 反应后质量/g | 待测 | 2.56 | 7.20 | 0.50 |
| A. | a和b是反应物,d可能是催化剂 | |
| B. | 反应后a物质质量为3.84g | |
| C. | c物质中其原子种类、数目和a、b物质中原子种类、数目相同 | |
| D. | 若物质a与b的相对分子质量之比为2:1,则化学反应中a与b的化学计量数比为1:2 |
14.2013年11月29日,圆通“夺命快递”在卸载环节受到危险化学品氟乙酸甲酯(化学式为C3H5FO2,有剧毒)污染,造成了人员伤亡.下列关于氟乙酸甲酯的说法正确的是( )
| A. | 氟乙酸甲酯是由碳、氢、氟、氧四种元素组成的化合物 | |
| B. | 氟乙酸甲酯中含有3个碳原子、5个氢原子、1个氟原子、2个氧原子 | |
| C. | 氟乙酸甲酯是由C3H5FO2分子构成 | |
| D. | 氟乙酸甲酯组成的元素中,氟元素质量分数最小 |


 A-H是初中化学中的常见物质,AB都是黑色固体,D是紫红色固体,AD都是单质,G的俗名叫熟石灰,F的俗名叫苏打,H是含有二种元素的一种常见酸,物质之间的关系如图.(“--”表示两种物质会发生反应,“→”表示前者通过反应能生成后者)
A-H是初中化学中的常见物质,AB都是黑色固体,D是紫红色固体,AD都是单质,G的俗名叫熟石灰,F的俗名叫苏打,H是含有二种元素的一种常见酸,物质之间的关系如图.(“--”表示两种物质会发生反应,“→”表示前者通过反应能生成后者)