题目内容
在托盘天平两边各放一只烧杯并注入相同质量、相同溶质质量分数的稀盐酸,调节至平衡,然后向左、右两边烧杯中分别投入等质量的镁和铝,待完全反应后,镁有剩余,则还可观察的现象是( )
分析:根据物质之间的反应以及反应的化学方程式进行分析,从酸过量和金属过量两个方面分析,因此解题时判断氢气多少则成为解题的关键所在.
解答:解:此题中两边相同质量、相同质量分数的稀盐酸,由于同质量的铝、镁完全反应,铝生成的氢气多,因此反应后镁有剩余可判断铝一定有剩余,因金属都有剩余,故酸一定完全反应,此题中酸的质量相等,所以生成的氢气质量一定相等;从金属活动性看铝的活动性比镁弱,所以放出氢气的速度是镁大于铝,从而可判断还可观察到的现象是:铝有剩余;先偏向右,最后平衡;
故选AB.
故选AB.
点评:本题考查了金属与酸反应与物理知识的结合,完成此题,可以依据物质间反应的化学方程式以及酸过量或金属过量的角度进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在托盘天平两边各放一只烧杯,调节至平衡.在两烧杯中分别注入等质量等浓度且足量的稀硫酸,在左烧杯中投入少量的锌粒,在右烧杯中投入相同质量的镁条,锌粒和镁条完全溶解后,天平的指针( )
| A、偏左 | B、偏右 | C、指向中间 | D、无法判断 |

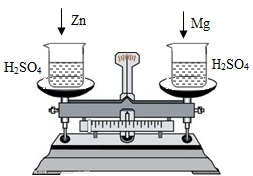 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( ) 在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )
在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )