题目内容
【题目】化学与生活息息相关。
(1)某食品的配料标签如图所示,

①该配料中富含蛋白质的物质是_____。
②从营养均衡角度看,该食品中除水外,还缺少的营养素是_____。
③这种食物对胃酸过多的病人有一定益处,原因是:_____。(用化学方程式表示)
(2)溧水地铁S7号线很快将正式开通。选择与此有关的以下三种材料填空(填字母):
①钢轨建设需要大量的钢铁,钢铁属于_____。
②座椅上常用到耐磨、耐腐蚀的涤纶等,涤纶属于_____。
A 金属材料 B 合成材料 C 复合材料
(3)某工厂每天产生含H2SO4的质量分数为1%废硫酸9.8t,如果用邻近工厂每天产生的废碱液(主要成分为NaOH)20t,恰好将其中和。求废碱液中NaOH的质量分数。_____(写出计算过程)
【答案】鸡蛋 维生素 NaHCO3+HCl=NaCl+H2O+CO2↑ A B 4%
【解析】
(1)①由食品的配料标签可知,该配料中富含蛋白质的物质是鸡蛋。
②从营养均衡角度看,该食品中除水外,还缺少的营养素是维生素。
③这种食物对胃酸过多的病人有一定益处,原因是碳酸氢钠能与胃液中的稀盐酸反应,方程式是:NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)①钢轨建设需要大量的钢铁,钢铁属于金属材料。
②座椅上常用到耐磨、耐腐蚀的涤纶等,涤纶属于合成材料;
(3)该9.8t废硫酸中H2SO4的质量为:9.8t×1%=0.098t;
设废碱液中NaOH的质量为x

解得:x=0.08t
废碱液中NaOH的质量分数:![]() ×100%=0.4%。
×100%=0.4%。

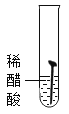
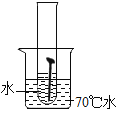
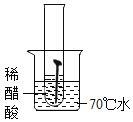
【题目】一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究。
(实验一)取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验。
实验图示 |
|
|
|
|
|
生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
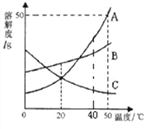
(1)通过上述实验可知,温度越高铁钉生锈速率越_____(填“慢”或“快”);在_____(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快。
(实验二)为探究铁锈的成分,用下图所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
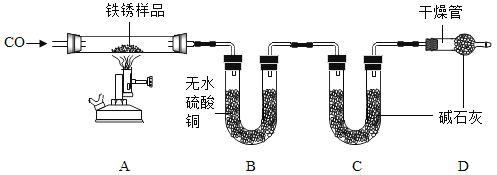
(查阅资料)①无水硫酸铜能吸收水而变蓝,
②碱石灰成分为氢氧化钠和氧化钙,既能吸收水也能吸收CO2。
(2)请指出该实验装置的一个缺陷:_____。
(3)A中加热前,先通入CO一段时间,目的是_____。
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有_____元素,从而推断出空气中的_____参加了铁生锈反应。
(实验记录)
铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
反应前 | 23.2 | 232.4 | 198.2 |
充分反应后 | 11.2 | 239.6 | 211.4 |
根据上表数据推算,可确定铁锈的成分,用FexOynH2O表示,则n=_____。
(5)若缺少D装置,x:y的值_____(填“偏大”、“偏小”或“无影响”)。
(实验三)小组同学将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。

(6)回答下列问题:
①ab段发生反应的化学方程式是_____。
②bc段发生反应的化学方程式是_____。
③cd段压强变化的主要原因是_____。