题目内容
14.某科学兴趣小组的同学对呼吸面具的制氧原理产生了好奇心,通过查阅资料得知,呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2),过氧化钠分别能和二氧化碳、水反应,都能生成氧气,反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2
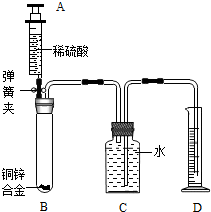
为测定呼吸面具中过氧化钠的质量分数,该小组的同学在教师的指导下,利用下图所示的装置(固定装置已略去)开展探究,并得出正确结论.
已知装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物.整套装置气密性良好,反应所需试剂均足量.

请回答下列问题:
(1)装置A的作用是产生实验所需的二氧化碳;写出A中发生反应的化学方程式CaCO3+2HCl=CaCl2+H20+CO2↑.
(2)不用装置E取代装置C的理由是碱石灰还能与二氧化碳反应;
(3)装置D中过氧化钠样品的质量为 mg装置D在反应前后质量分别为n1g和n2g,若样品中所含杂质既不溶于水,也不参加化学反应,则样品中过氧化钠的质量分数=$\frac{1950({n}_{2}-{n}_{1})}{7m}$%.
分析 (1)根据装置的特点分析作用,石灰石与盐酸反应生成氯化钙、水和二氧化碳;
(2)根据碱石灰的性质分析;
(3)根据过氧化钠与二氧化碳的反应,由二氧化碳的质量求出过氧化钠的质量,在求出质量分数.
解答 解:(1)由装置可知,装置A的作用是制取二氧化碳气体;石灰石与盐酸反应生成氯化钙、水和二氧化碳,方程式为CaCO3+2HCl=CaCl2+H20+CO2↑;
(2)由于装置E中的碱石灰能与二氧化碳反应,不能用装置E代替装置C.
(3)设过氧化钠的质量为x
2Na2O2+2CO2═2Na2CO3+O2 增加量
156 88 32 56
x n2g-n1g
$\frac{156}{x}$=$\frac{56}{{n}_{2}g-{n}_{1}g}$
解得:x=$\frac{156({n}_{2}g-{n}_{1}g)}{56}$
药品中过氧化钠的质量分数为:$\frac{\frac{156({n}_{2}g-{n}_{1}g)}{56}}{mg}$×100%=$\frac{1950({n}_{2}-{n}_{1})}{7m}$%;
故答为:(1)产生实验所需的二氧化碳;CaCO3+2HCl=CaCl2+H20+CO2↑;
(2)碱石灰还能与二氧化碳反应;
(3)$\frac{1950({n}_{2}-{n}_{1})}{7m}$%.
点评 该题根据查阅资料提供的信息并结合实验步骤和现象解决问题.主要考查读题能力,能把题目所给信息与所学知识进行牵连.知道性质决定用途,用途体现性质.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
3.下列实验操作不正确的是( )
| A. | 实验结束后,剩余药品要倒入指定的容器内 | |
| B. | 过滤后,发现滤液仍有混浊,应再次过滤 | |
| C. | 加热试管中的液体时,不能将管口对着人 | |
| D. | 将食盐固体放在天平右盘的滤纸上称量 |
 【实验原理及实验方案设计】
【实验原理及实验方案设计】