题目内容
14.现有M、N两物质在室温下的饱和溶液,升温后,M溶液有晶体析出,而N溶液还可以再溶解N晶体,则能正确表示M、N两种物质溶解度曲线的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 大多数固体物质的溶解度随温度的升高而增大,温度升高时这些物质的饱和溶液就会变成不饱和溶液;而有极少数的物质它们的溶解度是随温度的升高而减少,如果给它们的饱和溶液升高时,它们的溶解度就会减小,它们的饱和溶液就会有晶体析出.
解答 解:由于升温时M的饱和溶液有晶体析出,说明M的溶解度是随温度的升高而减小;而N的饱和溶液升温后N的溶液还可以溶解N晶体,说明N的饱和溶液已经变成了不饱和溶液,说明N的溶解度是随温度的升高而增大的,
故选B
点评 本题主要考查了固体的溶解度和温度之间的关系,以此来培养学生分析问题、解决问题的能力.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
4.下列化学式书写正确的是( )
| A. | 硫酸铜 CuS | B. | 氯酸钾 KclO3 | C. | 氢氧化钙Ca(OH)2 | D. | 氧化铁FeO |
5.某化学兴趣小组通过查阅资料知道,电解水时生成氢气和氧气的体积比为2:1,但实验所得数据氢气和氧气的体积比略大于2:1.针对这一发现,你认为下列说法中不可取的是( )
| A. | 大胆提出假设:氧气比氢气易溶于水 | |
| B. | 查找实验装置是否漏气 | |
| C. | 反复多次实验查找原因 | |
| D. | 实验所得数据与理论值相差不多,可以认为实验已经成功 |
2.完成如表反应的文字表达式并注明所属的基本反应类型
通过对(1)、(2)、(3)反应的比较可以发现它们有许多相似之处,其一是物质与氧气发生的化学反应;其二是属于化合反应.
| 化学反应文字表达式 | 基本反应类型 | |
| (1)硫在氧气中燃烧 | ||
| (2)碳在氧气中燃烧 | ||
| (3)铁在氧气中燃烧 | ||
| (4)过氧化氢分解制取氧气 | ||
| (5)加热氯酸钾制取氧气 |
6.实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
(1)则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
②二氧化碳在饱和的碳酸氢钠溶液中几乎不溶解,在27℃、101kPa时的密度为1.8g•L-1.
【实验探究1】
(2)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】
小红同学设计了如图1所示的装置(铁架台略去),在27℃、101kPa下按下列步骤进行实验:
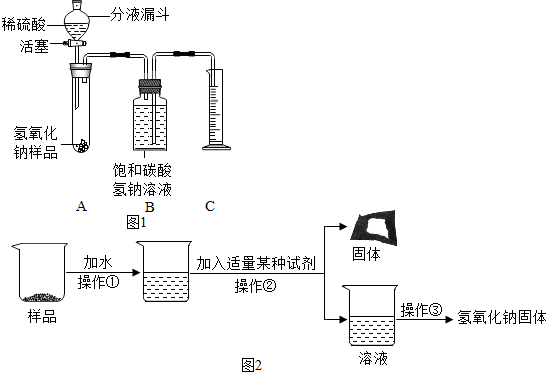
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入X溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到X溶液220mL.
(3)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检查装置的气密性.
(4)B中集气瓶盛装的X溶液应为饱和碳酸氢钠溶液.
(5)试管中原有的空气对实验结果没有(选填“有”或“没有”)明显影响.
(6)变质氢氧化钠样品中碳酸钠的质量分数为48%(精确至1%).
【提出问题3】怎样提纯该样品得到较纯净的氢氧化钠固体?
【实验探究3】
为了得到较纯净的氢氧化钠固体,小亮明设计了如图2所示的实验流程.
(7)操作②的名称是过滤,为了使样品充分溶解,操作①中还要用到的玻璃仪器是玻璃棒.
(8)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(9)最终所得氢氧化钠固体的质量变质样品中氢氧化钠的质量大于(选填“大于”、“等于”或“小于”).
【反思与交流】
(10)敞口放置的氢氧化钠溶液容易变质,所以试剂瓶要用橡皮塞密封保存.
(11)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质后某成分的含量,以及除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地
④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(12)【实验探究1】中的检验和【实验探究3】中的除杂都将碳酸钠进行了转化,但二者目的不同,它们分别是检验中将碳酸钠转化为氯化钠,以排除对氢氧化钠检验的干扰、除杂中是将碳酸钠转化为产品氢氧化钠.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
(1)则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
②二氧化碳在饱和的碳酸氢钠溶液中几乎不溶解,在27℃、101kPa时的密度为1.8g•L-1.
【实验探究1】
(2)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (a)取少量样品溶于水,加入过量的氯化钙溶液; | 有白色沉淀产生 | 该反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl |
| (b)静置,向将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅱ成立 |
【实验探究2】
小红同学设计了如图1所示的装置(铁架台略去),在27℃、101kPa下按下列步骤进行实验:

①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入X溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到X溶液220mL.
(3)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检查装置的气密性.
(4)B中集气瓶盛装的X溶液应为饱和碳酸氢钠溶液.
(5)试管中原有的空气对实验结果没有(选填“有”或“没有”)明显影响.
(6)变质氢氧化钠样品中碳酸钠的质量分数为48%(精确至1%).
【提出问题3】怎样提纯该样品得到较纯净的氢氧化钠固体?
【实验探究3】
为了得到较纯净的氢氧化钠固体,小亮明设计了如图2所示的实验流程.
(7)操作②的名称是过滤,为了使样品充分溶解,操作①中还要用到的玻璃仪器是玻璃棒.
(8)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(9)最终所得氢氧化钠固体的质量变质样品中氢氧化钠的质量大于(选填“大于”、“等于”或“小于”).
【反思与交流】
(10)敞口放置的氢氧化钠溶液容易变质,所以试剂瓶要用橡皮塞密封保存.
(11)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质后某成分的含量,以及除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地
④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(12)【实验探究1】中的检验和【实验探究3】中的除杂都将碳酸钠进行了转化,但二者目的不同,它们分别是检验中将碳酸钠转化为氯化钠,以排除对氢氧化钠检验的干扰、除杂中是将碳酸钠转化为产品氢氧化钠.
3.下列变化中,前者是化学变化,后者是物理变化的是( )
| A. | 锅炉爆炸海水晒盐 | B. | 牛奶变酸米酿成醋 | ||
| C. | 矿石粉碎食物腐烂 | D. | 蜡烛燃烧酒精挥发 |
 根据如图所示实验,并阅读小资料,回答下列问题.
根据如图所示实验,并阅读小资料,回答下列问题.