题目内容
| |||||||||||
答案:
解析:
解析:
(1) |
5;444 |
(2) |
(2)略解:设:生成222 ml CO2所消耗HCl的质量为x;所消耗的NaHCO3质量为y;与HCl反应的Na2CO3质量为z;混合物中NaHCO3的质量为a NaHCO3-HCl-CO2 84 36.5 44 y x 222×10-3l×1.98g/l x=0.365 g y=0.84 g ∴盐酸的质量分数= Na2CO3-HCl NaHCO3-CO2 106 36.5 84 44 z 5g×3.65% a 556×10-3l×1.98g/l Z=0.53 g a=2.10 g ∴混合物中NaHCO3的质量=2.10-0.84=1.26 g |

练习册系列答案
相关题目

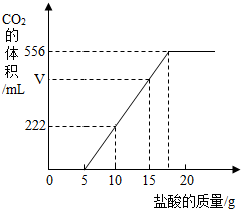 现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.
现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.


