题目内容
 将14.4g由NaCl和CaCl2组成的固体混合物溶于水配成60g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量与所得溶液的总质量关系如图:
将14.4g由NaCl和CaCl2组成的固体混合物溶于水配成60g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量与所得溶液的总质量关系如图:(1)当恰好完全反应时,得到沉淀的质量为
(2)当恰好完全反应后,过滤,求所得滤液中溶质的质量分数为多少?
分析:向NaCl和CaCl2组成的固体混合物溶于水所得的混合溶液中滴加碳酸钠时,混合溶液中的氯化钙与碳酸钠反应可生成碳酸钙沉淀;当氯化钙完全反应后,继续滴加的碳酸钠溶液不再产生沉淀,因此滴加碳酸钠溶液的质量与溶液质量增加值相等;
结合质量关系图,可得出:当加入50g碳酸钠溶液时,氯化钙恰好完全反应;利用质量守恒定律,反应生成沉淀碳酸钙的质量=60g+50g-100g=10g;根据反应的化学方程式,利用生成的碳酸钙可计算参加反应的碳酸钠的质量、生成氯化钠的质量;
所得滤液为氯化钠溶液,其溶质质量分数=
×100%,计算所得滤液中溶质的质量分数.
结合质量关系图,可得出:当加入50g碳酸钠溶液时,氯化钙恰好完全反应;利用质量守恒定律,反应生成沉淀碳酸钙的质量=60g+50g-100g=10g;根据反应的化学方程式,利用生成的碳酸钙可计算参加反应的碳酸钠的质量、生成氯化钠的质量;
所得滤液为氯化钠溶液,其溶质质量分数=
| 生成氯化钠的质量+原固体中氯化钠质量 |
| 反应后所得溶液质量100g |
解答:解:(1)根据所加入的碳酸钠溶液能与氯化钙反应生成碳酸钙沉淀和氯化钠,结合质量关系图中曲线变化特点,可判断当加入50g碳酸钠溶液时恰好与氯化钙完全反应,此时溶液的总质量为100g;根据质量守恒定律,生成沉淀碳酸钙的质量=60g+50g-100g=10g;
故答案为:10;50;
(2)设生成10g沉淀时反应消耗氯化钙的质量为x,反应生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y
=
x=11.1g
=
y=11.7g
所得滤液中溶质的质量分数=
×100%=15%
答:所得滤液中溶质的质量分数为15%.
故答案为:10;50;
(2)设生成10g沉淀时反应消耗氯化钙的质量为x,反应生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y
| 111 |
| x |
| 100 |
| 10g |
| 100 |
| 10g |
| 117 |
| y |
所得滤液中溶质的质量分数=
| 11.7g+(14.4g-11.1g) |
| 100g |
答:所得滤液中溶质的质量分数为15%.
点评:根据反应发生的实际情况并结合质量关系图,利用曲线的变化特点判断恰好完全反应时溶液的质量是解决本题的关键.

练习册系列答案
相关题目
 将14.4g由NaCl和CaCl2组成的固体混合物,溶于45.6g的水中,向所得到的混合溶液中逐滴加入质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与产生沉淀的质量关系如图:
将14.4g由NaCl和CaCl2组成的固体混合物,溶于45.6g的水中,向所得到的混合溶液中逐滴加入质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与产生沉淀的质量关系如图: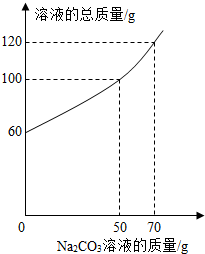 将14.4g由NaCl和CaCl2组成的固体混合物溶于水配成60g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量与所得溶液的总质量关系如图:
将14.4g由NaCl和CaCl2组成的固体混合物溶于水配成60g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量与所得溶液的总质量关系如图:
