题目内容
11.如图为元素周期表第三周期的一部分,据此判断下列说法中正确的是( )| 11Na 23.00 | 12Mg 24.31 | 13Al 26.98 | 14Si 28.09 |
| A. | Si的相对原子质量是28.09 | |
| B. | Mg原子的核外电子排布是 | |
| C. | Na+的质子数、核外电子数均为11 | |
| D. | 等质量的钠、镁、铝中所含原子个数由多到少的顺序是Na>Mg>Al |
分析 A、根据元素周期表可以获得的信息:汉字下面的数字表示相对原子质量.
B、根据镁元素周期表中的一格可知,左上角的数字为12,表示原子序数为12;根据原子序数=核电荷数=质子数,则镁元素的原子的核内质子数为12;镁原子核内有11个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有2个电子.
C、钠原子失去1个电子形成钠离子.
D、等质量的金属,所含原子个数最多,即原子质量最小;由原子的相对原子质量与其实际质量是成正比的关系,相对原子质量最小的即是原子个数最多的.
解答 解:A、由图中元素周期表可以获得的信息:汉字下面的数字表示相对原子质量,则Si的相对原子质量是28.09,故选项说法正确.
B、根据镁元素周期表中的一格可知,左上角的数字为12,表示原子序数为12;根据原子序数=核电荷数=质子数,则镁元素的原子的核内质子数为12;镁原子核内有11个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有2个电子,故选项说法错误.
C、钠原子失去1个电子形成钠离子,Na+的质子数为11,核外电子数为10,故选项说法错误.
D、原子的相对原子质量与其实际质量是成正比,由于相对原子质量的大小关系是铝>镁>钠,真实质量也是这一关系,故钠、镁、铝中所含原子个数由多到少的顺序是Na>Mg>Al,故选项说法正确.
故选:AD.
点评 本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)、原子结构示意图的含义是正确解答本题的关键.

练习册系列答案
相关题目
19. 作为哈尔滨有史以来规模最大、水准最高、功能最完善的标志性文化设施的哈尔滨大剧院建筑艺术风格独特,项目设计、建设难度及工艺复杂性在全国乃至世界都极富挑战性,其中部分设计建设元素为世界首创.下列有关说法错误的是( )
作为哈尔滨有史以来规模最大、水准最高、功能最完善的标志性文化设施的哈尔滨大剧院建筑艺术风格独特,项目设计、建设难度及工艺复杂性在全国乃至世界都极富挑战性,其中部分设计建设元素为世界首创.下列有关说法错误的是( )
 作为哈尔滨有史以来规模最大、水准最高、功能最完善的标志性文化设施的哈尔滨大剧院建筑艺术风格独特,项目设计、建设难度及工艺复杂性在全国乃至世界都极富挑战性,其中部分设计建设元素为世界首创.下列有关说法错误的是( )
作为哈尔滨有史以来规模最大、水准最高、功能最完善的标志性文化设施的哈尔滨大剧院建筑艺术风格独特,项目设计、建设难度及工艺复杂性在全国乃至世界都极富挑战性,其中部分设计建设元素为世界首创.下列有关说法错误的是( )| A. | 大剧院竣工后,将为我市增加一处亮丽景观 | |
| B. | 修建过程中用到的部分金属材料为合金,合金是纯净物 | |
| C. | 用到的石灰浆中含有氢氧化钙,氢氧化钙属于碱 | |
| D. | 涂刷油漆可以防止大剧院的钢结构生锈 |
6.区分下列各组物质所用的两种方法都合理的是( )
| 选项 | 需要区分的物质 | 方法一 | 方法二 |
| A | 氧化铜和木炭粉 | 放入水中,观察是否溶解 | 取样,分别滴加稀盐酸 |
| B | 硝酸钾和硝酸铵 | 分别溶于水,测温度 | 取样,加熟石灰研磨 |
| C | 生铁和钢 | 取样,分别加入硫酸铜溶液 | 分别用磁铁吸引 |
| D | 白酒和白醋 | 闻气味 | 取样,滴加酚酞 |
| A. | A | B. | B | C. | C | D. | D |
3.如图为元素周期的一部分,下列说法错误的是( )


| A. | 碳元素只能形成一种单质 | B. | 氢是非金属元素 | ||
| C. | 氧的相对原子质量为16.00 | D. | C、N、O的原子序数依次增加 |
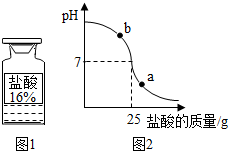
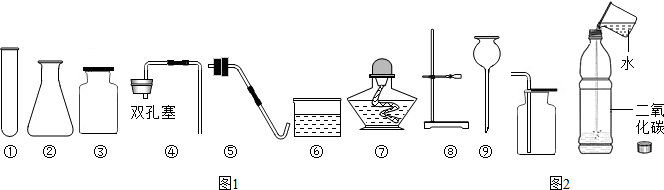
 现有如图初中化学常用的制取气体部分装置.请完成以下各题:
现有如图初中化学常用的制取气体部分装置.请完成以下各题: