题目内容
(7分)金属材料在我国建设中起着重要的作用。
(1)钢铁舰身的锈蚀主要是铁与空气中的_______共同作用的结果。
(2)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为 。
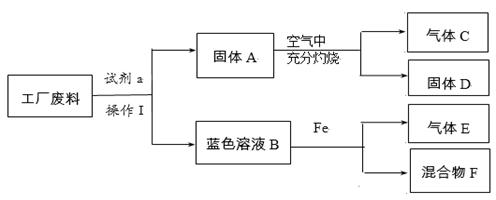
(3)回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后
可得到铜和硫酸亚铁溶液,主要流程如下。
已知:CuO + H2SO4 CuSO4 + H2O
Fe + Fe2(SO4) 3 3FeSO4
① 过程Ⅰ中氧化铁发生反应的化学方程式是________。
② 过程Ⅱ充分反应后,还应有的实验操作是_______。
③ 过程Ⅲ加入适量A,发生反应的化学方程式是________。
④ A~F中含铁元素的有 (填序号)。
(1)H2O和O2 (2)3CO + Fe2O3 高温 2Fe + 3CO2
(3)① Fe2O3 + 3H2SO4 Fe2(SO4) 3+ 3H2O ② 过滤
③ Fe + H2SO4 FeSO4 + H2↑ ④ BCDF
解析试题分析:(1)钢铁舰身的锈蚀主要是铁与空气中H2O和O2的共同作用的结果
(2)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为:3CO + Fe2O3 高温 2Fe + 3CO2
(3)此题是实验型的推断题,可以推断A为过量硫酸,这样溶液B中的溶质为CuSO4、FeSO4、H2SO4,所以C应该为铁,固体D为铁和铜的混合物,
①过程Ⅰ中氧化铁,能与过量的硫酸反应,发生反应的化学方程式是:Fe2O3+3H2SO4Fe2(SO4) 3+ 3H2O
② 过程Ⅱ充分反应后,还应有的实验操作是将固体和液体分离,是过滤操作
③ 过程Ⅲ加入适量硫酸,是将过量的铁反应掉,发生反应的化学方程式是:Fe + H2SO4 FeSO4 + H2↑
④ A~F中含铁元素的有:BCDF
考点:铁生锈的原理,铁的冶炼,实验型的推断题,酸的化学性质

小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【知识回放】金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,请你在横线上填写对应金属的元素符号。
【作出猜想】猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |  |  |  |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | |
【结论与解释】(1)小聪得到的结论是猜想 正确。
(2)实验前用砂纸打磨金属片的目的是 。
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式 。
下图为某化工企业生产流程示意图:
下列说法正确的是
| A.钛酸亚铁(FeTiO3)中钛元素为+3价 |
| B.①中反应方程式为:2FeTiO3+6C+7Cl2一定条件2X+2TiCl4+6CO,则X为FeCl3 |
| C.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 |
| D.③中氩气(Ar)作保护气,反应类型为复分解反应 |
许多植物花瓣的浸出液遇到酸性或碱性溶液都会呈现出不同的颜色,在化学实验室中,常用作酸碱指示剂.现提取几中植物花瓣的浸出液分别滴入三种溶液中,实验记录如下表:
| 植物浸出液 | 稀盐酸溶液 | 氯化钠溶液 | 稀氢氧化钠溶液 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 牵牛花 | 红色 | 紫色 | 蓝色 |
| 玫瑰花 | 浅红色 | 浅红色 | 绿色 |
(1)上述花瓣浸出液中,不能作酸碱指示剂的是 .
(2)若将牵牛花浸出液加入到食醋中,溶液会变 色,若将玫瑰花浸出液加入某无色溶液中,溶液变绿色,则该溶液是pH 7(填“>”、“<”或“=”)