题目内容
7.实验室用一定质量分数的过氧化氢溶液50g和2g二氧化锰混合反应,完全反应后称得剩余物的质量为48.8g,则反应中放出氧气的质量是( )| A. | 1.2g | B. | 1.6g | C. | 2g | D. | 3.2g |
分析 根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,所以完全反应后称得剩余物质减少的质量就是生成气体的质量进行分析.
解答 解:根据质量守恒定律可知,反应中放出氧气的质量是:50g+2g-48.8g=3.2g.
故选:D.
点评 本题主要考查了质量守恒定律在化学计算中的应用,难度不大,需要在平时多加训练即可.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
2.某天然矿泉水中含Mg2+ 2.4mg/L,其水密度可近似看做是1g/cm3.则该500mL天然矿泉水中镁离子的质量分数为( )
| A. | 0.12% | B. | 0.24% | C. | 1.2×10-4% | D. | 2.4×10-4% |
16.将A试剂瓶(盛浓盐酸)和B试剂瓶(盛浓硫酸)打开瓶塞,敞口放置于空气中.一段时间后,符合两者共同变化的是( )
| A. | 两瓶中溶液的质量都增加 | B. | 两瓶中溶液的质量都减少 | ||
| C. | 两瓶中的溶剂质量都增加 | D. | 两瓶中的溶质质量分数都会减小 |





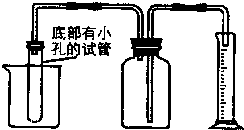 有一均匀的颗粒状铁、铜合金Wg.某学生利用如图所示的装置,通过测定合金与酸反应产生氢气的体积来测定合金中铁、铜的质量分数.
有一均匀的颗粒状铁、铜合金Wg.某学生利用如图所示的装置,通过测定合金与酸反应产生氢气的体积来测定合金中铁、铜的质量分数.