题目内容
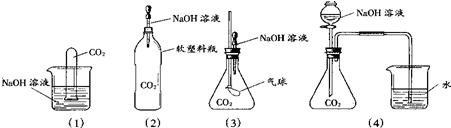
 17、稀盐酸与氢氧化钠的反应过程可以通过如模拟图示表示:
17、稀盐酸与氢氧化钠的反应过程可以通过如模拟图示表示:(1)该反应的基本反应类型是
复分解反应
;(2)该反应发生的实质是
H++OH-═H2O
;(3)反应后的溶液是否具有导电性其原因是
能导电,原因是溶液中存在能自由移动的离子
.分析:根据复分解反应的定义分析:复分解反应是指,两种化合物相互交换成分,生成另外两种化合物的反应.溶液能导电说明在溶液中有自由移动的离子.
解答:解:盐酸与氢氧化钠生成盐和水,是中和反应,基本类型为复分解反应.在盐酸与氢氧化钠反应生成难电离的水和氯化钠,所以此反应的实质为氢离子和氢离子生成水.因生成的氯化钠能电离出钠郭和氯离子,所以溶液能导电.
故答案为:
(1)复分解反应;
(2)H++OH-=H2O;
(3)能导电,原因是溶液中存在能自由移动的离子.
故答案为:
(1)复分解反应;
(2)H++OH-=H2O;
(3)能导电,原因是溶液中存在能自由移动的离子.
点评:中和反应是复分解反应的特例,但中和反应却不是基本反应类型.中和反应的实质为氢离子和氢氧根离子结合成水的过程.

练习册系列答案
相关题目
某产品常用粉末状的氢氧化钠、碳酸钙中的一种物质作为填充剂,小强同学对这种填充剂进行研究.他查阅资料得知,这种产品中只有填充剂与盐酸反应.他取该产品50g放入烧杯中,加入足量的稀盐酸200g,充分反反应后少杯中混合物的质量为239g.以下推断正确的是( )
| A、稀盐酸的质量分数等于8% | B、此产品中填充剂是碳酸钙 | C、填充剂的质量占该产品总质量的50% | D、此产品中的填充剂是氢氧化钠 |