题目内容
在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气泡产生.下列判断不正确的是( )
分析:根据金属活动性顺序表进行分析.在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答:解:根据金属活动顺序表可知,锌比铁活泼,铁比铜活泼.所以,加入一定量的锌粉,首先锌粉和硫酸铜溶液反应,置换出单质铜,如果锌粉足量可以继续与硫酸亚铁反应置换出铁.由题意可知,向滤出的固体中滴加稀硫酸,有气泡产生,说明固体中含有和稀硫酸反应的金属,由题可知,金属可能是铁或铁和锌.
A、由于铁或锌有剩余,所以,滤出的固体中一定含有铜,故A正确;
B、由于有与硫酸反应的金属,不论锌是足量还是不足量,滤出的固体中一定有铁.故B正确;
C、由于锌能与硫酸铜和硫酸亚铁反应,滤液中一定含有硫酸锌,故C正确;
D、由于固体中有铁或铁和锌,硫酸铜一定完全发生了反应.故D不正确.
故选D.
A、由于铁或锌有剩余,所以,滤出的固体中一定含有铜,故A正确;
B、由于有与硫酸反应的金属,不论锌是足量还是不足量,滤出的固体中一定有铁.故B正确;
C、由于锌能与硫酸铜和硫酸亚铁反应,滤液中一定含有硫酸锌,故C正确;
D、由于固体中有铁或铁和锌,硫酸铜一定完全发生了反应.故D不正确.
故选D.
点评:本题主要考查了学生对金属活动顺序表的运用,在解题时要注意对半定量(如一定量、过量、少量等)概念的理解和掌握.

练习册系列答案
相关题目
某化学活动小组探究金属的反应规律。
【探究一】在室温条件下进行右图所示实验。
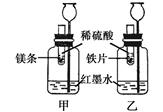
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为 。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 ;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 。
【探究一】在室温条件下进行右图所示实验。

已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为 。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 ;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 。
| A.滤出的固体中一定含有铜 |
| B.滤出的固体可能含有铁和镁 |
| C.滤液中可能含有硫酸铜 |
| D.滤液中一定含有硫酸镁和硫酸亚铁 |
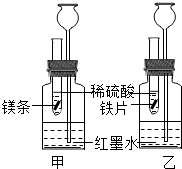 (2012?朝阳区一模)某化学活动小组探究金属的反应规律.
(2012?朝阳区一模)某化学活动小组探究金属的反应规律.